Badanie mapowania mózgu finansowane przez NIH ujawnia, które typy komórek mogą zostać dotknięte jako pierwsze.
Nowe badania finansowane przez Narodowe Instytuty Zdrowia (NIH) to sugeruje Alzheimera choroba może wpływać na mózg w dwóch odrębnych stadiach. Korzystając z zaawansowanej technologii mapowania mózgu, badacze proponują, aby początkowa, wczesna faza przebiegała stopniowo i cicho, skupiając się jedynie na niewielkiej liczbie wrażliwych typów komórek na długo przed pojawieniem się problemów z pamięcią.
Natomiast późniejsza faza charakteryzuje się rozległymi uszkodzeniami, związanymi z wystąpieniem objawów i szybkim gromadzeniem się płytek, splątań i innych charakterystycznych objawów choroby Alzheimera.
„Jednym z wyzwań stojących przed diagnozowaniem i leczeniem choroby Alzheimera jest to, że większość uszkodzeń mózgu następuje na długo przed pojawieniem się objawów. Możliwość wykrycia tych wczesnych zmian oznacza, że po raz pierwszy możemy zobaczyć, co dzieje się z mózgiem danej osoby w najwcześniejszych okresach choroby” – powiedział Richard J. Hodes, lekarz medycyny, dyrektor NIH National Institute on Aging. „Wyniki zasadniczo zmieniają wiedzę naukowców na temat tego, jak choroba Alzheimera uszkadza mózg i posłużą do opracowania nowych metod leczenia tej wyniszczającej choroby”.
Analiza komórkowa i kluczowe ustalenia
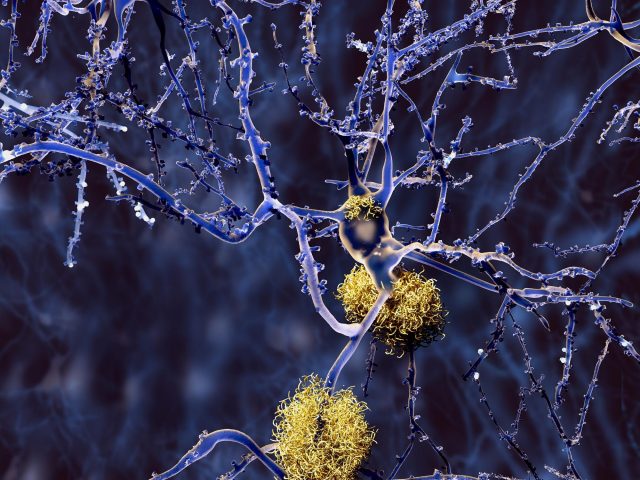
Naukowcy przeanalizowali mózgi 84 osób, a wyniki opublikowano w Neuronauka przyrodniczasugerują, że uszkodzenie jednego rodzaju komórek, zwanego neuronem hamującym, we wczesnej fazie może wywołać problemy z obwodami nerwowymi leżące u podstaw choroby. Ponadto badanie potwierdziło wcześniejsze ustalenia dotyczące uszkadzania mózgu przez chorobę Alzheimera i zidentyfikowało wiele nowych zmian, które mogą wystąpić w trakcie choroby.

W szczególności naukowcy wykorzystali zaawansowane narzędzia analizy genetycznej do badania komórek środkowego zakrętu skroniowego – części mózgu kontrolującej język, pamięć i wzrok. Wykazano, że zakręt jest podatny na wiele zmian tradycyjnie obserwowanych podczas choroby Alzheimera.
Jest to również część mózgu, którą badacze dokładnie zmapowali dla dawców kontrolnych. Porównując dane dawców kontrolnych z danymi osób chorych na chorobę Alzheimera, naukowcy stworzyli genetyczną i komórkową oś czasu przebiegu choroby.
Nowe podejście do postępu choroby Alzheimera: model dwufazowy
Tradycyjne badania sugerowały, że uszkodzenia powodowane przez chorobę Alzheimera zachodzą w kilku etapach, charakteryzujących się rosnącym poziomem śmierci komórek, stanem zapalnym i gromadzeniem się białek w postaci płytek i splotów. Dla kontrastu, badanie to sugeruje, że choroba zmienia mózg w dwóch „epokach” – lub fazach – przy czym wiele tradycyjnie badanych zmian zachodzi szybko w drugiej fazie. Zbiega się to z pojawieniem się problemów z pamięcią i innymi objawami.

Wyniki sugerują również, że najwcześniejsze zmiany zachodzą stopniowo i „po cichu” w pierwszej fazie, zanim pojawią się jakiekolwiek objawy. Zmiany te obejmują powolne gromadzenie się płytek, aktywację układu odpornościowego mózgu, uszkodzenie izolacji komórkowej, która pomaga neuronom wysyłać sygnały, oraz śmierć komórek zwanych neuronami hamującymi somatostatynę (SST).
Ostatnie odkrycie było zaskakujące dla badaczy. Tradycyjnie naukowcy uważali, że choroba Alzheimera uszkadza przede wszystkim neurony pobudzające, które wysyłają aktywujące sygnały nerwowe do innych komórek. Neurony hamujące wysyłają uspokajające sygnały do innych komórek. Autorzy artykułu postawili hipotezę, w jaki sposób utrata neuronów hamujących SST może wywołać zmiany w obwodach nerwowych mózgu, które leżą u podstaw choroby.
Nowe odkrycia w badaniach genów choroby Alzheimera
Niedawno osobne mapowanie mózgu sfinansowane przez NIH badanie przeprowadzone przez naukowców z MIT odkryli, że gen o nazwie REELIN może być powiązany z podatnością niektórych neuronów na chorobę Alzheimera. Wykazano również, że gwiaździste komórki mózgowe zwane astrocytami mogą zapewniać odporność na szkody spowodowane przez chorobę lub stawiać opór.
Naukowcy przeanalizowali mózgi znajdujące się w atlasie komórek mózgowych choroby Alzheimera w Seattle (SEA-AD), którego zadaniem jest stworzenie bardzo szczegółowej mapy uszkodzeń mózgu występujących podczas choroby. Projektem kierowali dr Mariano I. Gabitto i dr Kyle J. Travaglini z Instytutu Allena w Seattle. Naukowcy wykorzystali narzędzia — opracowane w ramach projektu NIH Badania mózgu poprzez rozwój innowacyjnych neurotechnologii® Inicjatywa (BRAIN). – Cell Census Network (BICCN) — w celu zbadania ponad 3,4 miliona komórek mózgowych od dawców, którzy zmarli na różnych etapach choroby Alzheimera. Próbki tkanek pobrano od Dorosłe zmiany w myśleniu studia i Uniwersytet Waszyngtoński Centrum Badań nad Chorobą Alzheimera (link is external).
„To badanie pokazuje, jak potężne nowe technologie dostarczone w ramach inicjatywy BRAIN Initiative NIH zmieniają sposób, w jaki rozumiemy choroby takie jak choroba Alzheimera. Dzięki tym narzędziom naukowcy byli w stanie wykryć najwcześniejsze zmiany komórkowe w mózgu, aby stworzyć pełniejszy obraz tego, co dzieje się w trakcie całego przebiegu choroby” – powiedział dr John Ngai, dyrektor The BRAIN Initiative®. „Nowa wiedza zdobyta w ramach tego badania może pomóc naukowcom i twórcom leków na całym świecie w opracowaniu metod diagnostycznych i terapii ukierunkowanych na określone etapy choroby Alzheimera i innych demencji”.
Odniesienie: „Zintegrowany multimodalny atlas komórek choroby Alzheimera” autorstwa Mariano I. Gabitto, Kyle J. Travaglini, Victoria M. Rachleff, Eitan S. Kaplan, Brian Long, Jeanelle Ariza, Yi Ding, Joseph T. Mahoney, Nick Dee, Jeff Goldy, Erica J. Melief, Anamika Agrawal, Omar Kana, Xingjian Zhen, Samuel T. Barlow, Krissy Brouner, Jazmin Campos, John Campos, Ambrose J. Carr, Tamara Casper, Rushil Chakrabarty, Michael Clark, Jonah Cool, Rachel Dalley, Martin Darvas, Song-Lin Ding, Tim Dolbeare, Tom Egdorf, Luke Esposito, Rebecca Ferrer, Lynn E. Fleckenstein, Rohan Gala, Amanda Gary, Emily Gelfand, Jessica Gloe, Nathan Guilford, Junitta Guzman, Daniel Hirschstein, Windy Ho, Madison Hupp, Tim Jarsky, Nelson Johansen, Brian E. Kalmbach, Lisa M. Keene, Sarah Khawand, Mitchell D. Kilgore, Amanda Kirkland, Michael Kunst, Brian R. Lee, Mckaila Leytze, Christine L. Mac Donald, Jocelin Malone, Zoe Maltzer, Naomi Martin, Rachel McCue, Delissa McMillen, Gonzalo Mena, Emma Meyerdierks, Kelly P. Meyers, Tyler Mollenkopf, Mark Montine, Amber L. Nolan, Julie K. Nyhus, Paul A. Olsen, Maiya Pacleb, Chelsea M. Pagan , Nicholas Peña, Trangthanh Pham, Christina Alice Pom, Nadia Postupna, Christine Rimorin, Augustin Ruiz, Giuseppe A. Saldi, Aimee M. Schantz, Nadiya V. Shapovalova, Staci A. Sorensen, Brian Staats, Matt Sullivan, Susan M. Sunkin , Carol Thompson, Michael Tieu, Jonathan T. Ting, Amy Torkelson, Tracy Tran, Nasmil J. Valera Cuevas, Sarah Walling-Bell, Ming-Qiang Wang, Jack Waters, Angela M. Wilson, Ming Xiao, David Haynor, Nicole M Gatto, Suman Jayadev, Shoaib Mufti, Lydia Ng, Shubhabrata Mukherjee, Paul K. Crane, Caitlin S. Latimer, Boaz P. Levi, Kimberly A. Smith, Jennie L. Close, Jeremy A. Miller, Rebecca D. Hodge, Eric B. Larson, Thomas J. Grabowski, Michael Hawrylycz, C. Dirk Keene i Ed S. Lein, 14 października 2024 r., Neuronauka przyrodnicza.
DOI: 10.1038/s41593-024-01774-5
Badanie to zostało sfinansowane z grantów NIH: U19AG060909, P30AG066509, U19AG066567, U01AG006781. Dodatkowe fundusze zapewniła fundacja Nancy and Buster Alvord Endowment. Centrum Chorób Alzheimera Uniwersytetu Rush w Chicago, Illinois, udostępniło metadane dawców z projektu Religious Orders Memory/Memory and Aging Project.
Naukowcy mogą uzyskać dane z badania SEA-AD, przechodząc do strony tego badania strona internetowa.