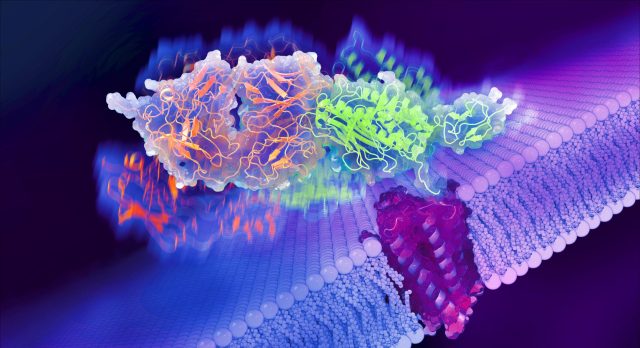
Naukowcy z Uniwersytet w Chicago z powodzeniem uchwycili szczegółowe obrazy receptorów sprzężonych z białkiem G adhezyjnym wraz z alternatywną metodą ich aktywacji. Ten przełom toruje drogę innowacyjnym możliwościom projektowania leków.
Prawie 35% leków zatwierdzonych przez Agencję ds. Żywności i Leków (FDA) działa na receptory sprzężone z białkiem G (GPCR), grupę białek osadzonych w błonach komórkowych, które umożliwiają komórkom komunikację. Wśród nich drugą co do wielkości rodziną u ludzi są receptory sprzężone z białkiem G (aGPCR). Jak sama nazwa wskazuje, aGPCR ułatwiają adhezję komórek, czyli zdolność komórek do sklejania się podczas przesyłania sygnałów w organizmie.
aGPCR odgrywają kluczową rolę w procesach takich jak wzrost tkanek, funkcjonowanie układu odpornościowego i rozwój narządów. Jednak zakłócenia w ich funkcjonowaniu mogą prowadzić do poważnych schorzeń, takich jak rak, zaburzenia neurologiczne i zaburzenia wzrostu. Pomimo ich znaczenia, nie zatwierdzono żadnych leków ukierunkowanych na aGPCR. Dzieje się tak głównie dlatego, że receptory te są wyjątkowo duże, złożone i trudne do zbadania.
Nowe badania przeprowadzone na Uniwersytecie w Chicago łączą dwie potężne techniki obrazowania w celu zbadania pełnej struktury powszechnego aGPCR, w tym interakcji jego długiego i złożonego regionu zewnątrzkomórkowego z regionem transbłonowym osadzonym na powierzchni komórki. Różne pozycje i ruchy obszaru zewnątrzkomórkowego wydają się być ważnym sposobem aktywacji receptora.
„Otwiera to nowe możliwości w zakresie adhezji GPCR, ponieważ teraz pokazujemy, że region zewnątrzkomórkowy komunikuje się z obszarem transbłonowym” – powiedział dr Demet Araç, profesor nadzwyczajny biochemii i biologii molekularnej na UChicago i główny autor nowego badania . Wyniki opublikowano w tym miesiącu w Komunikacja przyrodnicza.
Przechwytywanie nowych obrazów i nowych konfiguracji
Region zewnątrzkomórkowy aGPCR rozciąga się od błony komórkowej do przestrzeni na zewnątrz komórki, gdzie może wiązać się z cząsteczkami i receptorami innych komórek. Składa się z kilku domen, w tym domeny wywołującej autoproteolizę GPCR (GAIN), która może podzielić się na dwie części.
Powszechne zrozumienie sposobu aktywacji aGPCR jest takie, że ligand spoza komórki przyłącza się do jednej z domen zewnątrzkomórkowych i wywiera siłę, która oddziela domenę GAIN od jej drugiej części, peptydu zwanego uwiązanym agonistą (TA), który pozostaje przyłączony do obszaru transbłonowego. Kiedy TA jest oddzielony, może się poruszać i oddziaływać z regionem transbłonowym, aby zainicjować sygnalizację, ale coraz większa liczba badań biochemicznych pokazuje, że wiele funkcji aGPCR nie opiera się na tym mechanizmie zależnym od rozszczepienia. Oddzielenie domeny GAIN jest również nieodwracalne, pozostawiając receptor w ciągłym stanie „włączonym”, co może być szkodliwe dla komórki. Czasami komórka może potrzebować włączać i wyłączać receptor, więc musi istnieć jakiś inny sposób, aby to zrobić.
Laboratorium Araça pracowało przez 11 lat nad odkryciem struktury pełnowymiarowych receptorów aGPCR, mając nadzieję dowiedzieć się, w jaki sposób przychodzące sygnały są przesyłane z zewnątrz do wnętrza komórki. Receptory te są niezwykle trudne do pełnego zrozumienia, ponieważ regiony zewnątrzkomórkowe mają wiele złożonych i odrębnych konfiguracji. Doktorant Szymon Kordon kierował nowym badaniem, nawiązując do pracy poprzedniego studenta, aby uchwycić obrazy całej struktury Latrofiliny3, aGPCR zaangażowanego w rozwój synaps mózgowych, który jest również powiązany z zespołem nadpobudliwości psychoruchowej z deficytem uwagi i kilkoma nowotworami .
Kordon i Araç zoptymalizowali wytwarzanie i oczyszczanie Latrofiliny3 oraz przechwycili wstępne obrazy z mikroskopu elektronowego, jednak musieli stawić czoła licznym wyzwaniom, aby uzyskać dobry obraz receptora. Następnie współpracowali z dr Antonym Kossiakoffem, profesorem biochemii i biologii molekularnej w UChicago w Otho SA Sprague Distinguished Service, aby stworzyć syntetyczne przeciwciało, które mogłoby przyłączać się do aGPCR. Przeciwciało to stabilizowało region zewnątrzkomórkowy i nadało mu charakterystyczny kształt, który pozwolił Kordonowi uchwycić pełną strukturę receptora za pomocą mikroskopii krioelektronowej (cryo-EM), techniki obrazowania, która zamraża komórki i cząsteczki w celu uzyskania migawki. Powstałe obrazy stały się pierwszą znaną strukturą kompletnego aGPCR.
Obrazy Cryo-EM pokazały, że domena GAIN receptora przyjmuje kilka różnych pozycji w stosunku do powierzchni komórki. Każda inna pozycja domeny GAIN tworzyła inny punkt styku pomiędzy nią a regionem transbłonowym. Naukowcy zastanawiali się, czy te różne konfiguracje mogą stanowić inny sposób komunikacji z komórką, bez całkowitego oddzielania domeny GAIN. Dlatego nawiązali współpracę z dr Rezą Vafabakhshem, profesorem nadzwyczajnym w dziedzinie biologii molekularnej na Uniwersytecie Uniwersytet Północno-Zachodnii Kristiną Cechovą, badaczkę ze stopniem doktora w Northwestern, o przeprowadzenie drugiej serii eksperymentów, w ramach których śledzono ruchy obszarów zewnątrzkomórkowych.
Cechova i zespół wykorzystali obrazowanie rezonansowego transferu energii Förstera (FRET), które umożliwia pomiar transferu energii pomiędzy cząsteczkami znajdującymi się blisko siebie. Po przyłączeniu markerów fluorescencyjnych do różnych punktów zarówno w obszarach zewnątrzkomórkowych, jak i transbłonowych aGPCR, można było śledzić jego ruchy w odpowiedzi na siły adhezji ciągnące i popychające aGPCR. To, co zobaczyli, potwierdziło ich podejrzenia co do funkcji różnych konfiguracji.
„Różne stany konformacyjne są skorelowane z różną aktywnością sygnalizacyjną receptora” – powiedział Kordon. „To pokazuje funkcjonalne znaczenie tych konformacji w dalszej sygnalizacji w komórce”. Kordon, który ukończył studia w 2024 r., otrzymał później nagrodę za najlepszą rozprawę przyznaną przez Wydział Biochemii i Biologii Molekularnej Uniwersytetu UChicago za pracę nad tym projektem.
Nowy sposób aktywacji receptorów
Araç powiedział, że teraz, gdy lepiej rozumieją strukturę aGPCR i sposób ich działania, widzą potencjał ukierunkowania na nie leków w taki sam sposób, jak na inne receptory. Naukowcy mogliby zaprojektować przeciwciała takie jak te użyte w tym badaniu, aby ustabilizować je na potrzeby obrazowania, ale zamiast tego zaprojektować je w celu manipulowania ich aktywnością. Ponieważ aGPCR mają różne kształty i struktury, przeciwciała te mogą być również bardzo precyzyjne. Ponieważ u ludzi zidentyfikowano już 33 różne aGPCR, istnieje wiele możliwości.
„To może być przyszłość GPCR związanych z adhezją leków” – powiedział Araç. „Zaletą tego jest to, że regiony zewnątrzkomórkowe bardzo się od siebie różnią, więc można na nie namierzyć lek, który nie wiąże się z innymi receptorami i nie powoduje niepożądanych skutków ubocznych”.
Odniesienie: „Sprzężenie konformacyjne między domenami zewnątrzkomórkowymi i transbłonowymi moduluje funkcję holoadhezji GPCR” autorstwa Szymona P. Kordon, Kristina Cechova, Sumit J. Bandekar, Katherine Leon, Przemysław Dutka, Gracie Siffer, Anthony A. Kossiakoff, Reza Vafabakhsh i Demet Araç , 4 grudnia 2024 r., Komunikacja przyrodnicza.
DOI: 10.1038/s41467-024-54836-4
Badanie wsparła firma Narodowe Instytuty ZdrowiaChicago Biomedical Consortium i Narodowy Instytut Raka. Dodatkowymi autorami są Sumit J. Bandekar, Katherine Leon i Przemysław Dutka z UChicago oraz Gracie Siffer z Northwestern.