Naukowcy z Caltech wprowadzili rewolucyjną technikę opartą na uczeniu maszynowym, umożliwiającą dokładny pomiar masy poszczególnych cząstek przy użyciu zaawansowanych rozwiązań nanoskala urządzenia.
Metoda ta może radykalnie poszerzyć naszą wiedzę na temat proteomów, umożliwiając pomiar masy białek w ich natywnych postaciach, oferując w ten sposób nowy wgląd w procesy biologiczne i mechanizmy chorobowe.
Naukowcy z Caltech opracowali metodę opartą na uczeniu maszynowym, która umożliwia precyzyjny pomiar poszczególnych cząstek i cząsteczek przy użyciu zaawansowanych urządzeń w nanoskali. Ten przełom może doprowadzić do zastosowania różnych urządzeń do pomiaru masy, co jest kluczowe w identyfikacji białek. Posiada również potencjał do mapowania całego proteomu – pełnego zestawu białek w organizmie.
Białka są niezbędne do życia i napędzają prawie wszystkie procesy biologiczne. Zrozumienie, które białka są produkowane, gdzie się znajdują i w jakich ilościach może ujawnić istotne informacje na temat zdrowia organizmu, dostarczyć wskazówek na temat chorób i zasugerować nowe podejścia do leczenia. Jednak obecne metody nie pozwalają jeszcze na pełną charakterystykę proteomów.
„Teraz mówimy o spektrometrii mas na poziomie pojedynczej cząsteczki; możliwość patrzenia na całe białka w czasie rzeczywistym bez ich dzielenia” – mówi Michael Roukes, profesor fizyki, fizyki stosowanej i bioinżynierii Franka J. Rosheka oraz autor artykułu w czasopiśmie Komunikacja przyrodnicza który opisuje nową technikę. „Jeśli będziemy dysponować techniką jednocząsteczkową o wystarczająco dużej wydajności, aby móc zmierzyć miliony białek w rozsądnym czasie, będziemy w stanie faktycznie zrozumieć cały proteom organizmów, w tym ludzi”.
Potęga spektrometrii mas
Spektrometria mas jest powszechnym narzędziem analitycznym, którego używają naukowcy do wykonywania wszelkiego rodzaju badań molekularnych. Zacznij od tajemniczej próbki, zjonizuj ją (tj. naładuj ją, usuwając jeden lub więcej elektronów) i wyślij ją z prędkością po określonej drodze. Następnie użyj pola magnetycznego lub elektrycznego, aby popchnąć jony z boku i zobaczyć, jak daleko się poruszają. Im lżejsze i bardziej dodatnio naładowane jony, tym bardziej będą odchylane; umożliwia to zmierzenie masy i ładunku każdego z różnych obecnych jonów. Mając te informacje, badacze mogą spróbować określić skład chemiczny próbki.
Spektrometrię mas wykorzystuje się do wielu celów, w tym do analizy pierwiastków śladowych w medycynie sądowej, wykrywania biomarkerów chorób i analizy pozostałości pestycydów. Jednak początkowy etap jonizacji nie jest idealny dla wszystkich próbek, zwłaszcza próbek biologicznych, które mogą zostać zmienione w procesie.
Sprawa się komplikuje, gdy próbki stają się maleńkie — na przykład gdy naukowcy chcą określić masę pojedynczego białka. W ciągu ostatnich dwudziestu lat, wraz z rozwojem wyrafinowanych urządzeń w skali nano, zwanych systemami nanoelektromechanicznymi (NEMS), możliwe stało się przeprowadzanie takiego rodzaju spektrometrii mas, która nie wymaga wcześniejszej jonizacji próbki. Doprowadziło to do rutynowych pomiarów mas małych cząsteczek w czasie rzeczywistym. Dzięki takiemu podejściu naukowcy nie muszą zgadywać, interpretując daną substancję chemiczną gatunek najprawdopodobniej można je znaleźć w próbce. Jednakże metoda ta wykluczyła możliwość wykorzystania w spektrometrii mas niektórych złożonych urządzeń NEMS.
Postęp w urządzeniach NEMS
Spektrometrię mas NEMS wykonuje się zwykle za pomocą urządzenia krzemowego, które można sobie wyobrazić jako małą wiązkę umocowaną na obu końcach. Kiedy wiązka jest uderzana, rezonuje jak struna gitary i porusza się w górę i w dół z pewnymi kształtami trybów występującymi przy różnych częstotliwościach.
Jeśli na takiej wiązce zostanie umieszczona próbka, zmienią się poszczególne częstotliwości modów drgań wiązki. „Na podstawie tych zmian częstotliwości można wywnioskować masę próbki” – mówi John Sader, profesor naukowy w dziedzinie lotnictwa i fizyki stosowanej w Caltech oraz główny autor nowego artykułu. „Ale żeby to zrobić, musisz znać kształt każdego trybu. To jest obecnie sedno wszystkich tych pomiarów – trzeba wiedzieć, jak te urządzenia wibrują”.
W przypadku najnowszych urządzeń NEMS nie zawsze możliwe jest określenie dokładnego kształtu modu. Dzieje się tak dlatego, że w nanoskali występują różnice między urządzeniami lub niedoskonałości, które mogą nieznacznie zmieniać kształty trybów. Zaawansowane urządzenia NEMS, które naukowcy opracowali w celu badania podstawowej fizyki sfery kwantowej, charakteryzują się niezwykle skomplikowanymi trybami trójwymiarowymi, których częstotliwości są bardzo blisko siebie. „Nie można po prostu obliczyć kształtów drgań i ich częstotliwości, korzystając z teorii, i założyć, że utrzymują się one podczas pomiaru” – mówi Sader.
Kolejną komplikacją jest to, że dokładne miejsce upuszczenia próbki w urządzeniu wpływa na pomiary częstotliwości wiązki. Myśląc jeszcze raz o tym prostym urządzeniu z belką, jeśli próbkę umieści się blisko jednego z uwiązanych końców, częstotliwość nie zmieni się tak bardzo, jak gdyby została umieszczona na przykład blisko środka, gdzie amplituda drgań prawdopodobnie będzie większa. Jednak w przypadku urządzeń o rozmiarach mniej więcej jednego mikrona na jeden mikron nie jest możliwe wizualizowanie dokładnego rozmieszczenia próbki.
Masa cząsteczkowa odcisków palców
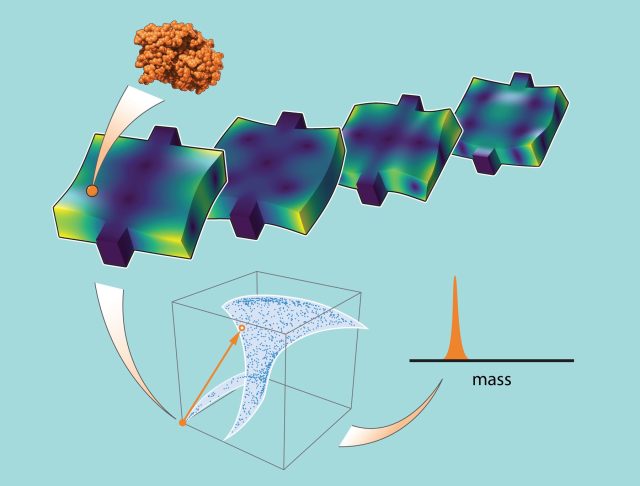
Sader, Roukes i ich współpracownicy opracowali nową technikę, którą nazywają „nanoelektromechaniczną spektrometrią mas odcisków palców”, która omija te problemy.
Stosując tę metodę, badacze losowo umieszczają pojedynczą cząstkę na urządzeniu NEMS w ultrawysokiej próżni i w ultraniskiej temperaturze. W czasie rzeczywistym mierzą, jak zmieniają się częstotliwości kilku trybów urządzenia w zależności od jego umiejscowienia. Pozwala im to skonstruować wielowymiarowy wektor reprezentujący te zmiany częstotliwości, z jednym wymiarem wektorowym dla każdego trybu. Robiąc to wielokrotnie dla cząstek umieszczonych w różnych losowych lokalizacjach, zbudowali bibliotekę wektorów dla urządzenia używanego do uczenia oprogramowania do uczenia maszynowego.
Okazuje się, że każdy wektor jest czymś w rodzaju odcisku palca. Ma identyfikujący kształt – lub kierunek – który zmienia się w sposób unikalny w zależności od tego, gdzie wyląduje cząstka.
„Jeśli wezmę cząstkę o nieznanej masie i umieszczę ją w dowolnym miejscu urządzenia NEMS – nie wiem, gdzie wylądowała; tak naprawdę jest mi to obojętne — mierzę częstotliwości modów wibracyjnych, a otrzymam wektor wskazujący konkretny kierunek” – wyjaśnia Sader. „Jeśli następnie porównam to ze wszystkimi wektorami w bazie danych i znajdę ten, który jest do niego najbardziej równoległy, to porównanie da mi nieznaną masę cząstki. To po prostu stosunek wielkości dwóch wektorów.”
Roukes i Sader twierdzą, że ta technika odcisków palców może działać z każdym urządzeniem. Na potrzeby tego badania zespół z Caltech teoretycznie przeanalizował urządzenia NEMS z kryształami fononowymi opracowane w laboratorium ich kolegi, fizyka ze Stanford, Amira Safavi-Naeni. Te zaawansowane urządzenia NEMS skutecznie wychwytują wibracje, dzięki czemu przy określonych częstotliwościach „dzwonią” przez długi czas, dając badaczom mnóstwo czasu na zebranie wysokiej jakości pomiarów. Metoda odcisków palców umożliwia pomiary spektrometrią mas za pomocą tych najnowocześniejszych urządzeń. W ramach przygotowań zespół wykorzystał alternatywne urządzenia do porównania metody odcisków palców. Obejmowało to pomiar masy poszczególnych cząstek GroEL, molekularnego białka opiekuńczego, które pomaga w prawidłowym fałdowaniu białek w komórce.
Roukes zauważa, że w przypadku dużych kompleksów białkowych i białek błonowych, takich jak GroEL, standardowe metody spektrometrii mas są problematyczne z kilku powodów. Po pierwsze, metody te zapewniają całkowitą masę i ładunek, a pomiary te nie pozwalają jednoznacznie zidentyfikować pojedynczego gatunku. W przypadku tak dużych kompleksów potencjalnych kandydatów byłoby wielu. „Trzeba to w jakiś sposób ujednoznacznić” – mówi Roukes. „Najlepszą metodą ujednoznacznienia w tym momencie jest wzięcie łamigłówki i pocięcie jej na fragmenty o długości od 3 do 20 aminokwasy długi.” Następnie, mówi, można by użyć rozpoznawania wzorców do zidentyfikowania cząsteczki macierzystej spośród wszystkich fragmentów potomnych. „Ale nie masz już unikalnego identyfikatora konfiguracji lub konformacji oryginalnej rzeczy, ponieważ zniszczyłeś ją w procesie siekania”.
Nowa technika odcisków palców, zauważa Roukes, „zmierza w stronę alternatywy zwanej natywną spektrometrią mas pojedynczych cząsteczek, w której patrzy się na duże białka i kompleksy białkowe, jeden po drugim, w ich natywnej postaci, bez ich siekania”.
Odniesienie: „Nanoelektromechaniczna spektrometria mas oparta na danych” autorstwa Johna E. Sadera, Alfredo Gomeza, Adama P. Neumanna, Alexa Nunna i Michaela L. Roukesa, 22 października 2024 r., Komunikacja przyrodnicza.
DOI: 10.1038/s41467-024-51733-8
Dodatkowymi autorami artykułu są Alfredo Gomez, absolwent Carnegie Mellon University, który podczas tego projektu był stypendystą Schmidt Academy for Software Engineering w Caltech; Adam P. Neumann (doktorat ’20), były absolwent laboratorium Roukesa w Caltech; oraz Alex Nunn, absolwent fizyki stosowanej w Caltech, który ukończył tę pracę jako młodszy specjalista ds. obliczeń w Instytucie. Prace są wspierane przez fundację Wellcome Leap w ramach programu Delta Tissue.