Naukowcy z Uniwersytet w Nagoi dokonali znaczącego przełomu w chemii, po raz pierwszy eksperymentalnie obserwując elektrony walencyjne cząsteczek organicznych.
Odkrycie to pogłębia naszą wiedzę na temat wiązań chemicznych i ma potencjalne zastosowania w farmacji i inżynierii chemicznej. Korzystając z nowo opracowanej metody CDFS, zaobserwowali fragmentaryczne chmury elektronów cząsteczek, takich jak glicyna i cytydyna, ujawniając zachowania mechaniki kwantowej i pomagając w projektowaniu materiałów funkcjonalnych.
Przełomowa obserwacja elektronów walencyjnych
Po raz pierwszy zespół badawczy z Uniwersytetu Nagoya w Japonii zaobserwował rozmieszczenie elektronów walencyjnych – elektronów na najbardziej zewnętrznej powłoce – cząsteczek organicznych. Ich przełomowe odkrycia, które rzucają światło na podstawową naturę wiązań chemicznych, zostały niedawno opublikowane w czasopiśmie „ Dziennik Amerykańskiego Towarzystwa Chemicznego. Te spostrzeżenia mają kluczowe znaczenie dla postępu w farmacji i inżynierii chemicznej.
Złożoność zachowania elektronów
Zachowanie elektronów w atomach jest złożone, tworząc orbitale elektronowe, które pełnią różne funkcje w zależności od ich bliskości do jądra. Elektrony powłoki wewnętrznej, zwane elektronami rdzenia, służą do samostabilizacji i nie oddziałują z innymi atomami. Z drugiej strony elektrony zewnętrzne, czyli elektrony walencyjne, definiują większość właściwości materiału, szczególnie podczas wiązania z innymi atomami.
Zrozumienie właściwości materiału wymaga wydobycia informacji o jego elektronach walencyjnych. Jednak eksperymentalne wyizolowanie jedynie informacji o elektronach walencyjnych było trudne, co spowodowało, że badacze musieli polegać na modelach teoretycznych i spektroskopii, aby je oszacować.
Prowadząc światowej klasy eksperymenty synchrotronowej dyfrakcji promieni rentgenowskich w godz Wiosna-8grupa odkryła, że możliwe jest selektywne wyodrębnienie jedynie gęstości elektronów walencyjnych atomów w krysztale.
Przełom w wizualizacji chmur elektronowych
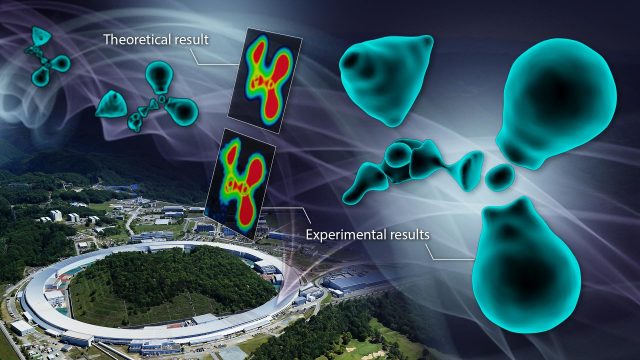
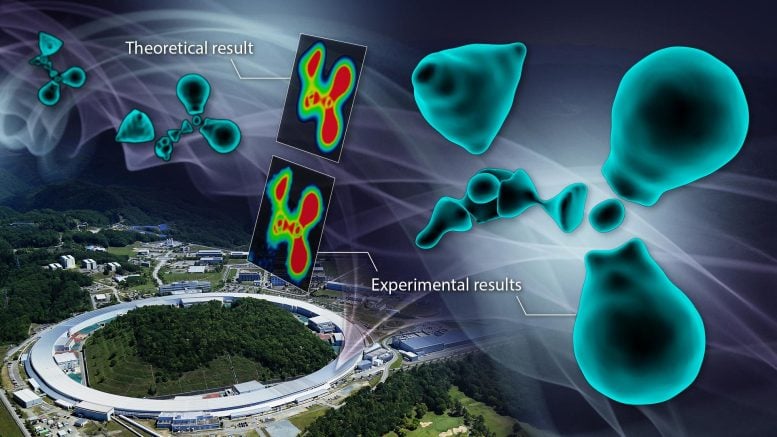
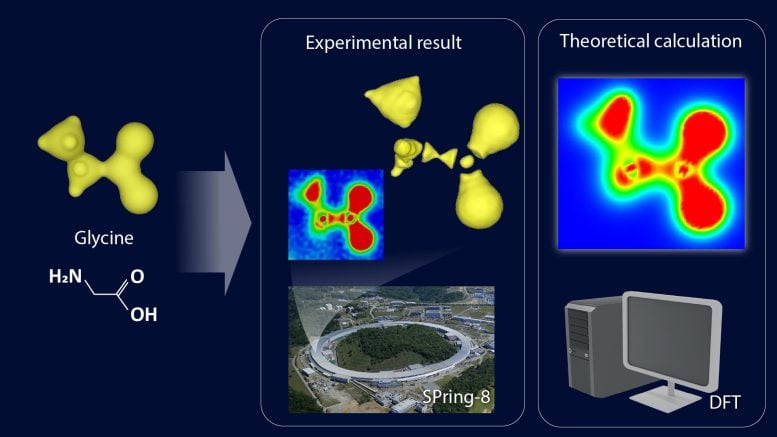
„Nazwaliśmy tę metodę metodą CDFS. Stosując tę metodę, zaobserwowaliśmy stan elektronowy cząsteczki glicyny, rodzaju grupy aminowej kwas”- powiedział korespondent Hiroshi Sawa. „Chociaż metoda była stosunkowo prosta w wykonaniu, wynik był imponujący. Zaobserwowana chmura elektronów nie wykazywała gładkiego, otaczającego kształtu, jak wielu przewidywało, ale raczej fragmentaryczny, dyskretny stan”.
Aby zrozumieć naturę wyników, grupa sporządziła kolorową mapę swoich obserwacji. W chemii mapa kolorów wykorzystuje kolory do wyświetlania różnic w zbiorach danych w określonym zakresie. Takie mapy są często używane w połączeniu z technikami spektroskopowymi, obrazowaniem i analizą chemiczną, aby zapewnić intuicyjny sposób interpretacji złożonych zbiorów danych.
Mapa przekroju poprzecznego na powiększonym schemacie wyraźnie pokazała przerwy w rozkładzie elektronów otaczających atomy węgla. „Kiedy węgiel tworzy wiązania z otaczającymi atomami, rekonstruuje swoją chmurę elektronów, tworząc zhybrydyzowane orbitale. W tym przypadku najbardziej zewnętrzne elektrony powłoki L mają węzły oparte na ich naturze falowej, znane jako funkcje falowe” – wyjaśnił Sawa. „Oznacza to, że ze względu na falową naturę elektronów, w niektórych częściach orbitali hybrydowych nie ma elektronów, co znacznie różni się od obrazu ciągłej „chmury” elektronów, jaki ma wielu ludzi”.
Spostrzeżenia mechaniki kwantowej z mapowania elektronów
Rozkład fragmentarycznej chmury elektronów zaobserwowany w eksperymencie pokazuje kwantowo-mechaniczną naturę fal elektronów, zgodnie z przewidywaniami fizyki. Aby potwierdzić, czy obserwowana chmura elektronów dokładnie oddaje rzeczywisty stan, przeprowadzili zaawansowane obliczenia chemii kwantowej we współpracy z Uniwersytet Hokkaido potwierdziło to, że wyniki eksperymentalne i teoretyczne idealnie do siebie pasują.
Sawa uważa, że wyniki pokazują korzyści płynące z badań interdyscyplinarnych. „Uważam, że pomogło to w uzyskaniu jasnych wniosków na temat niejednoznacznego rozumienia stanów wiązań, które intrygowało badaczy od XIX wieku” – stwierdziła Sawa. „Wizualizacja zachowania elektronów jest trudnym przedsięwzięciem, jednak wyniki można z łatwością zrozumieć jako elektrony działające zgodnie z funkcjami falowymi. Wierzę, że nasze odkrycia zadziwiły wielu badaczy i potwierdziły model zaproponowany przez chemię kwantową.”
Implikacje dla projektowania materiałów i badań chemicznych
Mając dokładne zrozumienie rozkładu gęstości elektronów walencyjnych tworzących tę cząsteczkę, grupa przeprowadziła podobne eksperymenty i obliczenia na cytydynie, nieco bardziej złożonej cząsteczce. Z powodzeniem wyodrębnili elektrony z podwójnych wiązań węgla i wyraźnie zaobserwowali różnice między wiązaniami węgiel-węgiel i węgiel-azot.
„To badanie umożliwiło bezpośrednią wizualizację istoty wiązań chemicznych, potencjalnie przyczyniając się do projektowania materiałów funkcjonalnych i zrozumienia mechanizmów reakcji. Dzieje się tak, ponieważ pomaga w omawianiu stanów elektronowych cząsteczek, które trudno wywnioskować na podstawie samego chemicznego wzoru strukturalnego” – powiedział Sawa. „Może na przykład wyjaśnić, dlaczego niektóre leki działają, a inne nie. Dziedziny, w których interakcje wpływają na funkcjonalność i stabilność strukturalną, takie jak organiczne półprzewodniki i badania nad strukturą DNA podwójne helisy, prawdopodobnie odniosą największe korzyści z naszych badań.”
Odniesienie: „Odsłonięcie natury wiązań chemicznych w rzeczywistej przestrzeni” autorstwa Takeshi Hara, Masatoshi Hasebe, Takao Tsuneda, Toshio Naito, Yuiga Nakamura, Naoyuki Katayama, Tetsuya Taketsugu i Hiroshi Sawa, 17 lipca 2024 r., Dziennik Amerykańskiego Towarzystwa Chemicznego.
DOI: 10.1021/jacs.4c05673