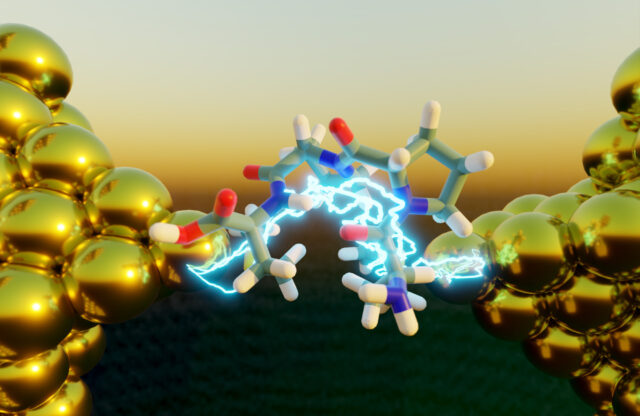
Transport elektronów, proces wytwarzania energii wewnątrz żywych komórek, który umożliwia fotosyntezę i oddychanie, jest wzmocniony w peptydach o zapadniętej, złożonej strukturze. Źródło: Moeen Meigooni.
Naukowcy potwierdzili swoje ustalenia, które opublikowano w czasopiśmie PNASwykorzystując kombinację eksperymentów na pojedynczych cząsteczkach, symulacji dynamiki molekularnej i mechaniki kwantowej.
Nowe badanie pokazuje, że peptydy o złożonej strukturze przewodzą prąd lepiej niż ich rozłożone odpowiedniki. Naukowcy z Instytutu Beckman wykorzystali eksperymenty i symulacje, aby wykazać, w jaki sposób struktury te wpływają na transport elektronów, kluczowy dla takich procesów jak fotosynteza i oddychanie. Odkrycie to nie tylko pogłębia naszą wiedzę na temat przepływu elektronów w złożonych strukturach molekularnych, ale także otwiera nowe możliwości opracowywania zaawansowanych molekularnych urządzeń elektronicznych.
Co dodaje energii elektronicznej peptydom? Z nowego badania wynika, że złożona konstrukcja Postępowanie Narodowej Akademii Nauk.
Transport elektronów, proces wytwarzania energii wewnątrz żywych komórek, który umożliwia fotosyntezę i oddychanie, jest wzmocniony w peptydach o zapadniętej, złożonej strukturze. Interdyscyplinarni badacze z Instytutu Zaawansowanej Nauki i Technologii Beckman połączyli eksperymenty na pojedynczych cząsteczkach, symulacje dynamiki molekularnej i mechanikę kwantową, aby potwierdzić swoje ustalenia.
„To odkrycie pozwala na nowe zrozumienie sposobu, w jaki elektrony przepływają przez peptydy o bardziej złożonych strukturach, oferując jednocześnie nowe możliwości projektowania i opracowywania bardziej wydajnych molekularnych urządzeń elektronicznych” – powiedział główny badacz Charles Schroeder, profesor ekonomii Jamesa w dziedzinie nauk o materiałach i inżynierii na uniwersytecie stanu Illinois Urbana-Champaign.
Białka znajdują się we wszystkich żywych komórkach i są integralną częścią czynności komórkowych, takich jak fotosynteza, oddychanie (pobieranie tlenu i wydalanie dwutlenku węgla) oraz skurcze mięśni.
Z chemicznego punktu widzenia białka są długimi sekwencjami aminokwasy nawleczone jak świąteczne lampki, różne kolory reprezentują różne aminokwasy, takie jak tryptofan i glutamina.
W najprostszej postaci białka (jego podstawowej strukturze) jest to grupa aminowa kwas sznurek leży płasko. Ale aminokwasy są podatne na mieszanie; kiedy oddziałują ze sobą, struna splata się, powodując załamanie strukturalne zwane fałdowaniem białka (lub strukturą wtórną).
Naukowcy zapytali, czy i w jaki sposób struktura białka wpływa na jego zdolność do przewodzenia prądu elektrycznego – na to pytanie nie ma jasnej odpowiedzi w istniejącej literaturze.
Badania skupiają się na peptydach
Rajarshi „Reeju” Samajdar, absolwent Grupy Schroeder, cierpliwie badał problem białek, eksperymentując na jednej cząsteczce na raz. Ale Samajdar w ogóle nie patrzył na białka. Zamiast tego skupił się na peptydach, fragmentach białek zawierających frakcję aminokwasów. W tym badaniu Samajdar użył peptydów zawierających około cztery lub pięć aminokwasów, co umożliwiło bardziej szczegółową obserwację – powiedział.
Samajdar dostrzegł coś zaskakującego: rozciągnięte peptydy o strukturze pierwszorzędowej wydawały się mniej skutecznymi przewodnikami energii niż ich złożone odpowiedniki o strukturze drugorzędowej. Wyraźna różnica między zachowaniem peptydów w każdym stanie wzbudziła jego ciekawość.
„Peptydy są bardzo elastyczne. Interesowało nas zrozumienie, jak zmieniają się właściwości przewodnictwa w miarę ich rozciągania i przejścia peptydów ze złożonej struktury drugorzędowej do konformacji wydłużonej. Co ciekawe, widziałem wyraźny przeskok między tymi dwiema strukturami, z których każda miała inne właściwości elektroniczne” – powiedział Samajdar.
Aby zweryfikować swoje obserwacje, Samajdar zwrócił się do Moeena Meigooniego, absolwenta asystenta badawczego pracującego z Emadem Tajkhorshidem, badaczem Beckmana, profesorem i katedrą biochemii J. Woodlanda Hastingsa.
Zespół przeprowadził symulację zachowania konformacyjnego peptydów za pomocą modelowania komputerowego, potwierdzając gwałtowne zmiany strukturalne zaobserwowane przez Samajdara. Nie pozostawiając żadnych śladów naukowych, badacze współpracowali z Martinem Mosquerą, adiunktem chemii na Montana State University i Nicholasem Jacksonem, badaczem Beckmana i adiunktem chemii w Illinois, aby użyć obliczeń mechaniki kwantowej w celu potwierdzenia, że te dwa dyskretne struktury rzeczywiście powiązano ze zmianami przewodności.
„Wierzymy, że nasze podejście, łączące eksperymenty na pojedynczych cząsteczkach, modelowanie strukturalne z dynamiką molekularną i mechaniką kwantową, to bardzo skuteczne podejście do zrozumienia elektroniki molekularnej” – powiedział Samajdar. „Mogliśmy przejść od razu do technologii kwantowej, ale tego nie zrobiliśmy. Symulacja komputerowa umożliwiła nam zbadanie całej przestrzeni konformacyjnej peptydów.”
Trzykrotnie sprawdzone wyniki naukowców wskazują, że peptydy o złożonej strukturze drugorzędowej rzeczywiście przewodzą prąd lepiej niż peptydy o rozwiniętej strukturze pierwszorzędowej. Zaobserwowana przez nich specyficzna struktura wtórna utworzyła kształt zwany 310 spirala.
Ponieważ prace te przeprowadzono na peptydach, wyniki pozwalają na lepsze zrozumienie transportu elektronów w większych, bardziej złożonych białkach i innych biomolekułach, wskazując na zastosowania w molekularnych urządzeniach elektronicznych, takich jak półprzewodniki które działają poprzez przełączanie pomiędzy dwiema odrębnymi strukturami.
Odniesienie: „Struktura wtórna determinuje transport elektronów w peptydach” Rajarshi Samajdar, Moeen Meigooni, Hao Yang, Jialing Li, Xiaolin Liu, Nicholas E. Jackson, Martín A. Mosquera, Emad Tajkhorshid i Charles M. Schroeder, 25 lipca 2024 r., Postępowanie Narodowej Akademii Nauk.
DOI: 10.1073/pnas.2403324121