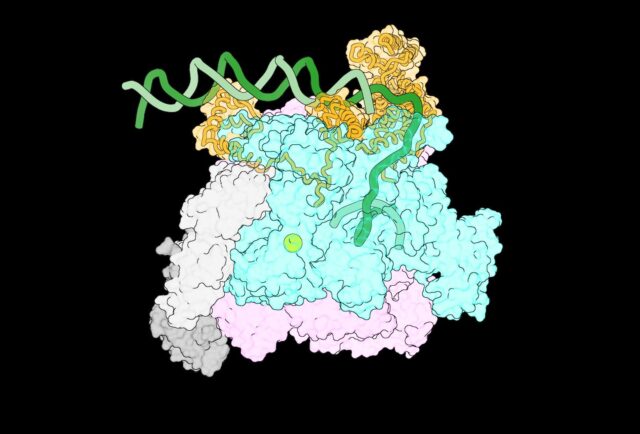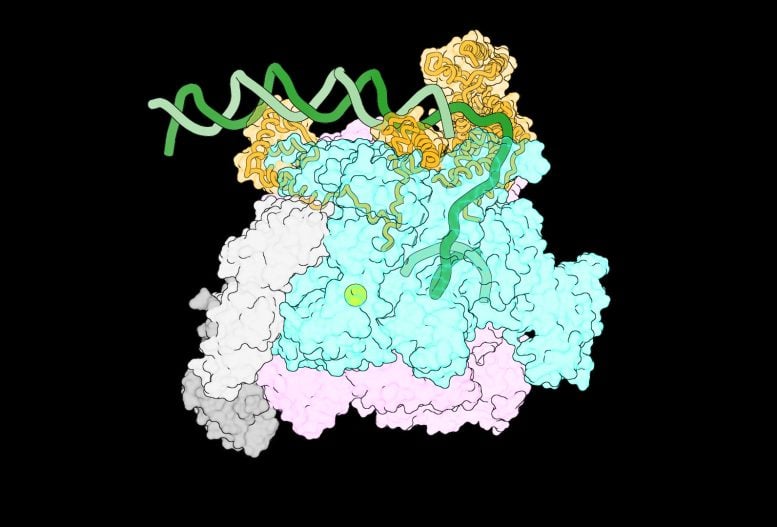
Jedno z pierwszych w historii zdjęć kompleksów pośrednich, które tworzą się, gdy polimeraza RNA napotyka DNA. Źródło: Laboratorium Biofizyki Molekularnej na Uniwersytecie Rockefellera
Ostatnie odkrycia pokazują, jak RNA polimeraza oddziałuje z DNA do zainicjowania transkrypcji, uchwycone w milisekundach przy użyciu zaawansowanych technik mikroskopowych. Ten przełom zapewnia nowy wgląd w mechanizmy regulujące ekspresję genów, pomagając w rozwiązaniu długotrwałych debat w tej dziedzinie.
Każda żywa komórka transkrybuje DNA na RNA. Proces ten rozpoczyna się, gdy enzym zwany polimerazą RNA (RNAP) przyłącza się do DNA. W ciągu kilkuset milisekund podwójna helisa DNA rozwija się, tworząc pęcherzyk transkrypcyjny, umożliwiając skopiowanie jednej odsłoniętej nici DNA na komplementarną nić RNA.
W dużej mierze nie wiadomo, w jaki sposób RNAP dokonuje tego wyczynu. Migawka RNAP w trakcie otwierania tej bańki dostarczyłaby wielu informacji, ale proces ten zachodzi zbyt szybko, aby obecna technologia mogła łatwo uchwycić wizualizacje tych struktur. Teraz nowe badanie w Przyroda Biologia strukturalna i molekularna opisuje RNAP E. coli w akcie otwierania bańki transkrypcyjnej.
Odkrycia, zarejestrowane w ciągu 500 milisekund od zmieszania RNAP z DNA, rzucają światło na podstawowe mechanizmy transkrypcji i odpowiadają na od dawna zadawane pytania dotyczące mechanizmu inicjacji i znaczenia jego różnych etapów. „Po raz pierwszy komukolwiek udało się uchwycić w czasie rzeczywistym przejściowe kompleksy transkrypcyjne w trakcie ich powstawania” – mówi pierwsza autorka Ruth Saecker, specjalistka ds. badań w laboratorium Setha Darsta w Rockefeller. „Zrozumienie tego procesu ma kluczowe znaczenie, ponieważ jest to główny krok regulacyjny w ekspresji genów”.
Widok bezprecedensowy
Darst jako pierwszy opisał strukturę bakteryjnego RNAP, a odkrywanie jego niuansów pozostaje głównym przedmiotem zainteresowania jego laboratorium. Choć dziesięciolecia pracy wykazały, że wiązanie RNAP z określoną sekwencją DNA uruchamia serię etapów otwierających bańkę, to sposób, w jaki RNAP oddziela nici i umieszcza jedną nić w jej miejscu aktywnym, pozostaje przedmiotem gorących dyskusji.
Wczesne prace w tej dziedzinie sugerowały, że otwarcie pęcherzyków stanowi krytyczne spowolnienie procesu, określając, jak szybko RNAP może przejść do syntezy RNA. Późniejsze wyniki w tej dziedzinie podważyły ten pogląd i pojawiło się wiele teorii na temat natury tego etapu ograniczającego szybkość działania. „Wiedzieliśmy z innych technik biologicznych, że kiedy RNAP po raz pierwszy styka się z DNA, tworzy grupę kompleksów pośrednich, które podlegają ścisłej regulacji” – mówi współautor Andreas Mueller, stażysta w laboratorium ze stopniem doktora. „Ale ta część procesu może zająć mniej niż sekundę, a my nie byliśmy w stanie uchwycić struktur w tak krótkim czasie”.
Aby lepiej zrozumieć te pośrednie kompleksy, zespół współpracował z kolegami z Centrum Biologii Strukturalnej w Nowym Jorku, którzy opracowali zrobotyzowany system oparty na drukarkach atramentowych, który mógł szybko przygotować próbki biologiczne do analizy za pomocą mikroskopii krioelektronowej. Dzięki tej współpracy zespół uchwycił kompleksy tworzące się w ciągu pierwszych 100–500 milisekund spotkania RNAP z DNA, uzyskując obrazy czterech różnych kompleksów pośrednich wystarczająco szczegółowe, aby umożliwić analizę.
Po raz pierwszy wyraźny obraz zmian strukturalnych i półproduktów, które powstają podczas początkowych etapów wiązania polimerazy RNA z DNA, został wyostrzony. „Technologia była niezwykle ważna w tym eksperymencie” – mówi Saecker. „Bez możliwości szybkiego mieszania DNA i RNAP i rejestrowania ich obrazu w czasie rzeczywistym, takie wyniki nie istnieją”.
Zajęcie pozycji
Po przeanalizowaniu tych obrazów zespołowi udało się nakreślić sekwencję zdarzeń pokazującą, w jaki sposób RNAP oddziałuje z niciami DNA podczas ich rozdzielania, z niewidzianym wcześniej poziomem szczegółowości. Gdy DNA się rozwija, RNAP stopniowo chwyta jedną z nici DNA, aby zapobiec ponownemu złożeniu się podwójnej helisy. Każda nowa interakcja powoduje zmianę kształtu RNAP, umożliwiając utworzenie większej liczby połączeń białko-DNA. Obejmuje to wypychanie jednej części białka, które blokuje DNA przed wejściem do miejsca aktywnego RNAP. W ten sposób tworzy się stabilny pęcherzyk transkrypcyjny.
Zespół proponuje, że etapem ograniczającym szybkość transkrypcji może być umiejscowienie nici matrycowej DNA w miejscu aktywnym enzymu RNAP. Ten krok polega na pokonaniu znaczących barier energetycznych i przestawieniu kilku komponentów. Przyszłe badania będą miały na celu potwierdzenie tej nowej hipotezy i zbadanie innych etapów transkrypcji.
„W tym badaniu przyjrzeliśmy się tylko najwcześniejszym etapom” – mówi Mueller. „Następnie mamy nadzieję przyjrzeć się innym kompleksom, późniejszym punktom czasowym i dodatkowym etapom cyklu transkrypcji”.
Oprócz rozwiązania sprzecznych teorii na temat sposobu wychwytywania nici DNA, wyniki te podkreślają wartość nowej metody, która może wychwytywać zdarzenia molekularne zachodzące w ciągu milisekund w czasie rzeczywistym. Technologia ta umożliwi znacznie więcej badań tego typu, pomagając naukowcom w wizualizacji dynamicznych interakcji w układach biologicznych.
„Jeśli chcemy zrozumieć jeden z najbardziej podstawowych procesów życiowych, zachodzący we wszystkich komórkach, musimy zrozumieć, w jaki sposób regulowany jest jego postęp i szybkość” – mówi Darst. „Kiedy już to wiemy, będziemy mieli znacznie jaśniejszy obraz tego, jak rozpoczyna się transkrypcja”.
Odniesienie: „Wczesne produkty pośrednie w stopieniu promotora bakteryjnej polimerazy RNA wizualizowane za pomocą czasowo rozdzielczej mikroskopii krioelektronowej” Ruth M. Saecker, Andreas U. Mueller, Brandon Malone, James Chen, William C. Budell, Venkata P. Dandey, Kashyap Maruthi , Joshua H. Mendez, Nina Molina, Edward T. Eng, Laura Y. Yen, Clinton S. Potter, Bridget Carragher i Seth A. Darst, 31 czerwca 2024 r., Przyroda Biologia strukturalna i molekularna.
DOI: 10.1038/s41594-024-01349-9