
Naukowcy z MIT wykorzystali profilowanie RNA jednokomórkowych do zbadania zmian w ekspresji genów w mózgach pacjentów z chorobą Alzheimera, koncentrując się na wrażliwości neuronów i czynnikach odporności poznawczej. Badanie podkreśliło znaczący wpływ wyczerpania się Reelin w niektórych neuronach i ochronną rolę astrocytów o specyficznej ekspresji genów.
Naukowcy z MIT przeprowadził szeroko zakrojone badania nt Alzheimera choroby, analizując ekspresję genów w różnych obszarach mózgu, aby zrozumieć, dlaczego określone komórki i obwody są podatne.
W badaniu zidentyfikowano neurony w hipokampie i korze śródwęchowej jako szczególnie podatne ze względu na zmniejszoną ekspresję białka Reelin, powiązaną z pogorszeniem funkcji poznawczych. Ponadto naukowcy odkryli, że astrocyty promują odporność poznawczą poprzez działanie przeciwutleniające i metabolizm choliny.
Nowe dowody na to, jak określone komórki i obwody stają się podatne na chorobę Alzheimera, ujawniono w badaniu MIT opublikowanym 24 lipca w czasopiśmie: Natura. W ogólnodostępnym badaniu skupiono się również na innych czynnikach, które mogą pomóc niektórym osobom wykazać odporność na pogorszenie funkcji poznawczych, nawet w przypadku wyraźnych oznak patologii chorobowej.
Aby podkreślić potencjalne cele interwencji mających na celu podtrzymanie funkcji poznawczych i pamięci, autorzy przeprowadzili nowatorskie porównanie ekspresji genów w wielu obszarach mózgu u osób z chorobą Alzheimera lub bez niej, a także przeprowadzili eksperymenty laboratoryjne w celu przetestowania i potwierdzenia swoich głównych ustaleń.
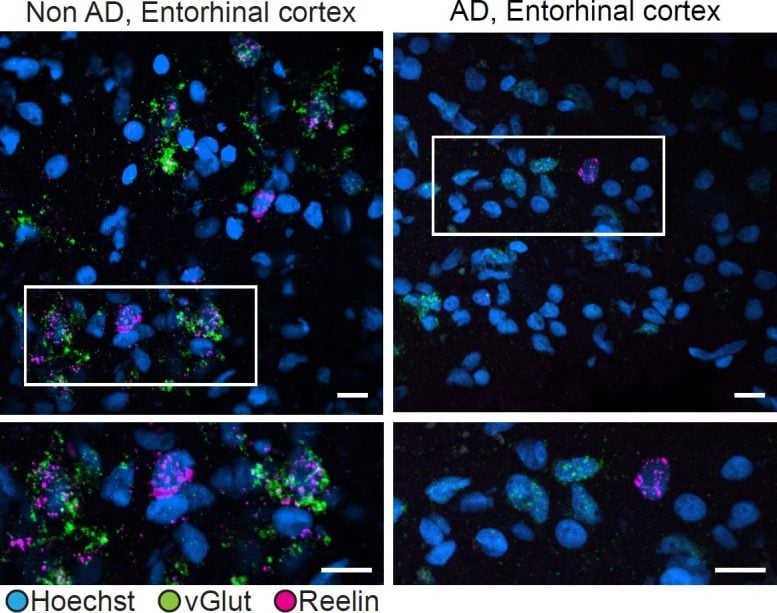
Naukowcy porównali ekspresję Reelina w neuronach pobudzających w korze śródwęchowej u osób chorych (po prawej) i bez (po lewej) choroby Alzheimera. U osób zdrowych vGlut (zielony), marker neuronów pobudzających, i Reelin (purpurowy) często ulegały ekspresji razem. U osób chorych na Alzheimera komórki pobudzające wykazywały znacznie mniejszą ekspresję Reelina. Źródło: Tsai Lab/MIT Picower Institute
Wzory ekspresji genów i różnice komórkowe w chorobie Alzheimera
Wszystkie komórki mózgowe mają to samo DNA ale tym, co je różni, zarówno pod względem tożsamości, jak i aktywności, są wzorce ekspresji tych genów. W nowej analizie zmierzono różnice w ekspresji genów w ponad 1,3 miliona komórek z ponad 70 typów komórek w sześciu obszarach mózgu od 48 dawców tkanek, z których 26 zmarło z powodu choroby Alzheimera, a 22 bez niej. W związku z tym badanie dostarcza wyjątkowo obszernego, dalekosiężnego, a jednocześnie szczegółowego obrazu różnic w aktywności komórek mózgowych w chorobie Alzheimera w zależności od typu komórki, regionu mózgu, patologii choroby i oceny funkcji poznawczych każdej osoby za życia.
„Określone obszary mózgu są wrażliwe w chorobie Alzheimera i istnieje istotna potrzeba zrozumienia, w jaki sposób te regiony lub określone typy komórek są podatne” – mówi współautor Li-Huei Tsai, profesor neurologii w Picower i dyrektor Instytutu Nauki i Uczenia się Picower. Inicjatywa Pamięć i starzenie się mózgu na MIT. „A mózg to nie tylko neurony. To wiele innych typów komórek. To, jak te typy komórek mogą różnie reagować w zależności od tego, gdzie się znajdują, jest czymś fascynującym, czemu przyglądamy się dopiero na początku”.
Zaawansowane techniki w badaniach nad chorobą Alzheimera
Współautor Manolis Kellis, profesor informatyki i szef Grupy Biologii Obliczeniowej MIT, porównuje technikę stosowaną do pomiaru porównań ekspresji genów do komórek jednokomórkowych RNA profilowanie, do bycia znacznie bardziej zaawansowanym „mikroskopem” niż te, które ponad sto lat temu pozwoliły Aloisowi Alzheimerowi scharakteryzować patologię choroby.
„Tam, gdzie Alzheimer dostrzegł pod swoim mikroskopem płytki białek amyloidowych i fosforylowane splątki tau, nasz jednokomórkowy «mikroskop» mówi nam, komórka po komórce i gen po genie, o tysiącach subtelnych, ale ważnych zmian biologicznych w odpowiedzi na patologię” – mówi Kellis. „Połączenie tych informacji ze stanem poznawczym pacjentów ujawnia, w jaki sposób reakcje komórkowe są powiązane z utratą funkcji poznawczych lub odpornością, i może pomóc w zaproponowaniu nowych sposobów leczenia utraty funkcji poznawczych. Patologia może poprzedzać objawy poznawcze o dekadę lub dwie, zanim zostanie zdiagnozowane pogorszenie funkcji poznawczych. Jeśli na tym etapie niewiele możemy zrobić z patologią, możemy przynajmniej spróbować zabezpieczyć szlaki komórkowe, które utrzymują funkcje poznawcze”.
Hansruedi Mathys, były postdoc z MIT w Tsai Lab, a obecnie adiunkt na Uniwersytecie w Pittsburghu; Carles Boix PhD ’22, były student w laboratorium Kellisa, obecnie postdoktor w Harvard Medical School; i Leyla Akay, absolwentka laboratorium Tsai, prowadziły badanie, analizując korę przedczołową, korę śródwęchową, hipokamp, wzgórze przednie, zakręt kątowy i korę środkowoskroniową. Próbki mózgu pochodziły z badania Religious Order Study oraz projektu Rush Memory and Aging Project na Uniwersytecie Rush.
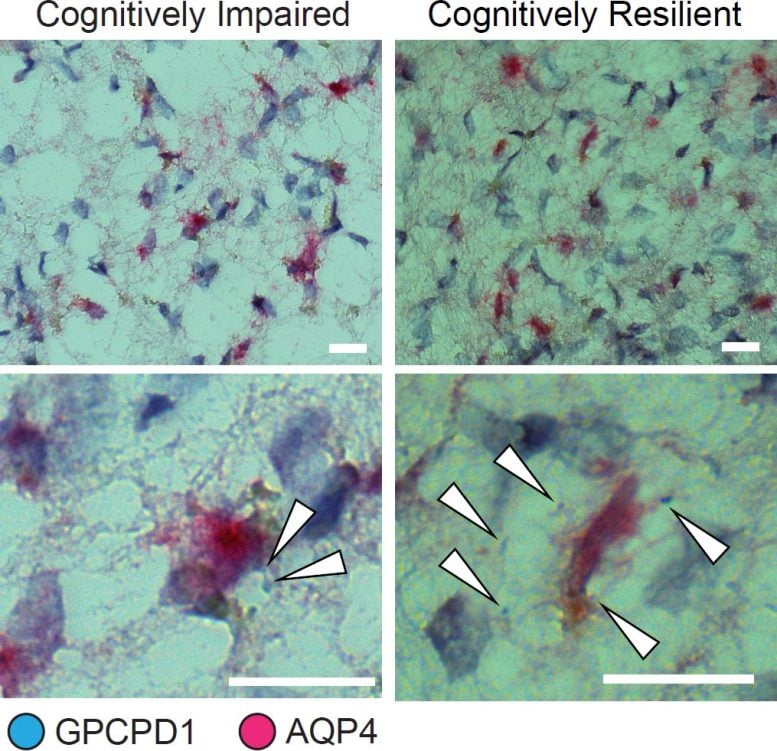
Ekspresja genu GPPCPD1 w komórkach astrocytów jest powiązana z odpornością poznawczą u osób z patologią Alzheimera. Tutaj białe strzałki wskazują przypadki ekspresji GPPCPD1 (niebieskie) w komórkach astrocytów (oznaczone przez barwienie AQP4 w kolorze magenta). W tkance jest znacznie więcej ekspresji osoby odpornej poznawczo (po prawej). Źródło: Tsai Lab/MIT Picower Institute
Wrażliwość neuronowa i Reelin
Niektóre z najwcześniejszych objawów patologii amyloidu i utraty neuronów w chorobie Alzheimera występują w obszarach skupionych na pamięci, zwanych hipokampem i korą śródwęchową. W tych obszarach oraz w innych częściach kory mózgowej badaczom udało się wskazać potencjalną przyczynę. Jeden typ neuronów pobudzających w hipokampie i cztery w korze śródwęchowej występowały znacznie rzadziej u osób z chorobą Alzheimera niż u osób bez niej. Osoby z wyczerpaniem tych komórek osiągały znacznie gorsze wyniki w ocenach funkcji poznawczych. Co więcej, wiele wrażliwych neuronów było połączonych wspólnym obwodem neuronowym. Co równie ważne, kilka z nich albo bezpośrednio wyrażało białko zwane Reelin, albo było bezpośrednio dotkniętych sygnalizacją Reelin. Podsumowując, odkrycia wyraźnie podkreślają szczególnie wrażliwe neurony, których utrata wiąże się z ograniczeniem funkcji poznawczych, a które mają wspólny obwód neuronowy i ścieżkę molekularną.
Tsai zauważa, że Reelin odegrał znaczącą rolę w badaniach nad chorobą Alzheimera z powodu: ostatnie badania mężczyzny w Kolumbii. Miał rzadką mutację w genie Reelin, która powodowała większą aktywność tego białka, i był w stanie zachować zdrowie poznawcze w zaawansowanym wieku, pomimo silnej predyspozycji rodzinnej do wczesnego wystąpienia choroby Alzheimera. Nowe badanie pokazuje, że utrata neuronów wytwarzających Reelin jest powiązana z pogorszeniem funkcji poznawczych. Podsumowując, może to oznaczać, że mózg odnosi korzyści ze stosowania Reelina, ale neurony, które go wytwarzają, mogą zostać utracone przynajmniej u niektórych pacjentów z chorobą Alzheimera.
„Możemy myśleć o Reelinie jako o działaniu ochronnym lub korzystnym” – mówi Akay. „Ale nie wiemy jeszcze, co robi ani w jaki sposób może zapewnić odporność”.
W dalszej analizie naukowcy odkryli również, że szczególnie wrażliwe podtypy neuronów hamujących zidentyfikowane we wcześniejszym badaniu z tej grupy w korze przedczołowej również były zaangażowane w sygnalizację Reelina, co jeszcze bardziej wzmocniło znaczenie tej cząsteczki i jej ścieżki sygnalizacyjnej.
Aby dokładniej sprawdzić swoje wyniki, zespół bezpośrednio zbadał próbki ludzkiej tkanki mózgowej i mózgi dwóch rodzajów myszy modelowych chorych na Alzheimera. Rzeczywiście, eksperymenty te wykazały również zmniejszenie liczby neuronów Reelin-dodatnich w korze śródwęchowej ludzi i myszy.
Czynniki odporności i zachowanie funkcji poznawczych
Aby znaleźć czynniki, które mogłyby zachować funkcje poznawcze nawet w obliczu patologii, zespół zbadał, które geny, w jakich komórkach i w jakich regionach są najściślej powiązane z odpornością poznawczą, którą zdefiniowali jako szczątkowe funkcje poznawcze, powyżej typowej utraty funkcji poznawczych oczekiwanej przy założeniu obserwowana patologia.
Ich analiza dała zaskakującą i konkretną odpowiedź: w kilku obszarach mózgu astrocyty wykazujące ekspresję genów związanych z aktywnością przeciwutleniającą oraz metabolizmem choliny i biosyntezą poliamin były w istotny sposób powiązane z trwałym funkcjonowaniem funkcji poznawczych, nawet przy wysokim poziomie tau i amyloidu. Wyniki potwierdziły wcześniejsze badania Wyniki kierowani przez Tsai i Susan Lundqvist, w którym wykazali, że suplement diety w postaci choliny pomaga astrocytom radzić sobie z rozregulowaniem gospodarki lipidowej powodowanym przez najważniejszy gen ryzyka choroby Alzheimera, wariant APOE4. Odkrycia dotyczące przeciwutleniaczy wskazały również na cząsteczkę, którą można znaleźć jako suplement diety, spermidynę, która może mieć właściwości przeciwzapalne, chociaż ustalenie przyczynowego takiego związku wymagałoby dalszych badań.
Tak jak poprzednio, zespół wyszedł poza przewidywania zawarte w analizie ekspresji RNA w pojedynczych komórkach i dokonał bezpośrednich obserwacji próbek w tkance mózgowej. Te pochodzące od osób odpornych poznawczo rzeczywiście wykazywały zwiększoną ekspresję kilku genów ulegających ekspresji w astrocytach, które według przewidywań są powiązane z odpornością poznawczą.
Nowa metoda analityczna i publiczny zbiór danych
Aby przeanalizować góry danych dotyczących pojedynczych komórek, badacze opracowali nową, solidną metodologię opartą na grupach genów ulegających skoordynowanej ekspresji (znanych jako „moduły genów”), wykorzystując w ten sposób wzorce korelacji ekspresji między funkcjonalnie powiązanymi genami w tym samym module.
„Zasadniczo 1,3 miliona zbadanych przez nas komórek mogłoby wykorzystywać swoje 20 000 genów w astronomicznej liczbie różnych kombinacji” – wyjaśnia Kellis. „W praktyce jednak obserwujemy znacznie mniejszy podzbiór skoordynowanych zmian. Rozpoznanie tych skoordynowanych wzorców pozwala nam wnioskować o znacznie solidniejszych zmianach, ponieważ opierają się one na wielu genach w tym samym funkcjonalnie połączonym module”.
Podał następującą analogię: mając wiele stawów w ciele, ludzie mogą poruszać się na różne szalone sposoby, ale w praktyce wykonują znacznie mniej skoordynowanych ruchów, takich jak chodzenie, bieganie czy taniec. Nowa metoda umożliwia naukowcom identyfikację takich skoordynowanych programów ekspresji genów jako grupy.
Chociaż laboratoria Kellisa i Tsai zgłosiły już kilka godnych uwagi wniosków ze zbioru danych, badacze spodziewają się, że w zbiorze danych wciąż czeka na odnalezienie wiele innych, potencjalnie znaczących odkryć. Aby ułatwić takie odkrycie, zespół udostępnił wraz z danymi przydatne narzędzia analityczne i wizualizacyjne na stronie internetowej Kellisa.
„Zbiór danych jest niezwykle bogaty. Skoncentrowaliśmy się tylko na kilku najistotniejszych aspektach, które naszym zdaniem są bardzo, bardzo interesujące, ale w żadnym wypadku nie wyczerpaliśmy tego, czego można się dowiedzieć z tego zbioru danych” – mówi Kellis. „Spodziewamy się przed nami wielu kolejnych odkryć i mamy nadzieję, że młodzi badacze (w każdym wieku) zajmą się tym tematem i zaskoczą nas wieloma dodatkowymi spostrzeżeniami”.
Kellis twierdzi, że w przyszłości naukowcy badają obwody kontrolne powiązane z genami ulegającymi zróżnicowanej ekspresji, aby zrozumieć warianty genetyczne, regulatory i inne czynniki napędzające, które można modulować w celu odwrócenia obwodów chorobowych w różnych obszarach mózgu, typach komórek i różnych obszarach mózgu. stadia choroby.
Odniesienie: „Jednokomórkowa wieloregionowa sekcja choroby Alzheimera” autorstwa: Hansruedi Mathys, Carles A. Boix, Leyla Anne Akay, Ziting Xia, Jose Davila-Velderrain, Ayesha P. Ng, Xueqiao Jiang, Ghada Abdelhady, Kyriaki Galani, Julio Mantero, Neil Band, Benjamin T. James, Sudhagar Babu, Fabiola Galiana-Melendez, Kate Louderback, Dmitry Prokopenko, Rudolph E. Tanzi, David A. Bennett, Li-Huei Tsai i Manolis Kellis, 24 lipca 2024 r., Natura.
DOI: 10.1038/s41586-024-07606-7
Dodatkowi autorzy badania to Ziting Xia, Jose Davila Velderrain, Ayesha P. Ng, Xueqiao Jiang, Ghada Abdelhady, Kyriaki Galani, Julio Mantero, Neil Band, Benjamin T. James, Sudhagar Babu, Fabiola Galiana-Melendez, Kate Louderback, Dmitry Prokopenko, Rudolph E. Tanzi i David A. Bennett.
Wsparcie dla badań pochodziło od Narodowy Instytut ZdrowiaInstytut Nauki i Pamięci Picower, Fundacja JPB, Fundusz Cure Alzheimer’s Fund, Fundacja Rodziny Roberta A. i Renee E. Belferów, Eduardo Eurnekian i Joseph DiSabato.




