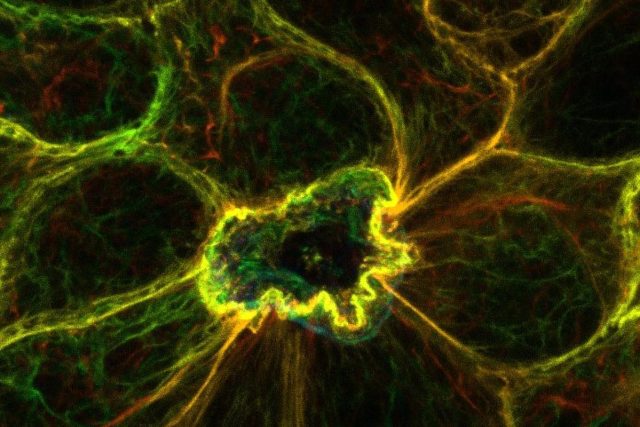
Naukowcy z Uniwersytetu Kyushu odkryli istotną rolę wapnia w usuwaniu martwych komórek w tkankach ochronnych naszego organizmu.
To odkrycie ma kluczowe znaczenie dla zrozumienia, w jaki sposób nasze ciała utrzymują zewnętrzne i wewnętrzne powierzchnie w czystości i zabezpieczają przed infekcjami. Badanie przeprowadzone przy użyciu zaawansowanych technik pokazuje, że gdy komórki w tych warstwach ochronnych obumierają, wapń pomaga sąsiednim komórkom szybko je usunąć, utrzymując zdrową barierę.
Odkrycie nowego mechanizmu komórkowego
Naukowcy z Uniwersytetu Kyushu w Japonii odkryli proces napędzany wapniem, kluczowy dla usuwania martwych komórek, co pogłębia naszą wiedzę na temat tego, w jaki sposób nasze ciała utrzymują zdrowie i zapobiegają chorobom. Opublikowano niedawno w czasopiśmie Aktualna biologiaich odkrycia pokazują, że poziom jonów wapnia jest niezbędny do skutecznego usuwania umierających komórek, zwanych komórkami apoptotycznymi, z tkanek nabłonkowych – są to komórki tworzące ochronną wyściółkę na powierzchniach ciała. W badaniu wykorzystano genetycznie zmodyfikowane hodowle tkanki nabłonkowej, markery molekularne i zaawansowane techniki obrazowania, aby obserwować ten proces.
Istotne bariery i obrona komórkowa
Komórki nabłonkowe pokrywają zewnętrzne i wewnętrzne powierzchnie naszego ciała, w tym skórę i narządy wewnętrzne, służąc jako niezbędne bariery ochronne. Kiedy komórki te ulegną uszkodzeniu i obumierają, co jest procesem znanym jako apoptoza, sąsiadujące komórki szybko współpracują, aby wyrzucić martwe komórki i zamknąć wszelkie otwory. Działanie to pomaga zapobiegać przedostawaniu się szkodliwych substancji, które mogą prowadzić do infekcji lub stanów zapalnych. Chociaż proces ten ma kluczowe znaczenie dla utrzymania integralności barier nabłonkowych, szczegółowe mechanizmy z nim związane nie zostały w pełni poznane aż do niedawnego odkrycia.
Badanie prowadzone pod kierunkiem profesora Junichi Ikenouchiego i jego współpracowników, dr Kenjiego Matsuzawy i pana Yumy Cho, pierwszego autora, z Uniwersytetu Kyushu, obejmowało także wkład współpracowników z Uniwersytetu Tokijskiego i Uniwersytetu Nauk o Zdrowiu w Hokkaido w Japonii.

Wprowadzenie do CarE: mechanizm reakcji na wapń
Na początek zespół wywołał apoptozę w poszczególnych komórkach nabłonkowych za pomocą skupionego lasera i obserwował reakcję w otaczających komórkach. Następnie zaobserwowali reakcję pobliskich komórek, modyfikując je w celu ekspresji specjalnych sond jonów wapnia zwanych GCaMP6, co pozwoliło im wizualizować zmiany wapnia w czasie rzeczywistym. Co ciekawe, odkryli, że sąsiedzi komórki apoptotycznej wykazali znaczny wzrost poziomu wapnia, szczególnie w pobliżu obszarów błony stykających się z umierającą komórką. Naukowcy nazwali to intrygujące zjawisko „reakcją wapniową w efektorach ekstruzji wierzchołkowej (CaRE)”.
Rola receptorów IP3 i desmosomów w usuwaniu komórek
Zagłębiając się w ten nowo odkryty mechanizm, zespół następnie zbadał rolę receptorów IP3 – białek obecnych wewnątrz komórek, które pomagają regulować poziom jonów wapnia. Odkryli, że hamowanie aktywności receptorów IP3 lub usuwanie powiązanych z nimi genów całkowicie zapobiega wydalaniu komórek apoptotycznych. Dalsza analiza z wykorzystaniem zaawansowanej mikroskopii elektronowej ujawniła, że kluczową rolę w CaRE odgrywa specyficzny podzbiór receptorów IP3, zwłaszcza tych zlokalizowanych w pobliżu desmosomów.
Desmosomy to struktury adhezyjne komórek, które tworzą silne połączenia między komórkami, zachowując się jak przyciski spajające je. Są szczególnie ważne w tkankach, takich jak skóra i wyściółki narządów, pomagając zachować wszystko w nienaruszonym stanie i prawidłowo funkcjonować. Zapewniając ścisłe przyleganie sąsiadujących komórek, desmosomy odgrywają kluczową rolę w utrzymaniu struktury i stabilności tkanek naszego organizmu. Zespół odkrył, że aktywacja receptorów IP3 w pobliżu desmosomów jest konieczna do wywołania skurczu grupy białek zwanej kompleksem aktomiozyny, który pomaga komórkom zmieniać kształt i poruszać się, ułatwiając usuwanie komórek apoptotycznych. „Nasze badanie rzuca światło na nowo odkrytą rolę receptorów IP3 w desmosomach, z których wcześniej sądzono, że te ostatnie biorą udział jedynie w połączeniach mechanicznych między komórkami nabłonkowymi” – podkreśla Ikenouchi.
Ponieważ badanie to przeprowadzono na komórkach hodowanych, zespół zauważa, że konieczna jest dalsza analiza mechanizmu CaRE, aby określić, czy mechanizm ten działa również w organizmach żywych, czy różni się w zależności od tkanki narządów i czy inne czynniki również odgrywają rolę.
Ogólnie rzecz biorąc, badanie to pogłębia naszą wiedzę na temat tego, w jaki sposób nasz organizm utrzymuje zdrowy nabłonek – coś, co wielu z nas uważa za oczywiste. „Nasze odkrycia dostarczają cennych informacji na temat chorób spowodowanych zaburzeniem bariery nabłonkowej, takich jak atopowe zapalenie skóry i choroba zapalna jelit, a także mogą przyczynić się do opracowania nowych środków zapobiegawczych i metod leczenia przewlekłego stanu zapalnego” – podsumowuje Ikenouchi.
Odniesienie: „Trwała odpowiedź wapniowa za pośrednictwem zakotwiczenia receptora IP3 w desmosomie jest niezbędna do eliminacji komórek apoptotycznych”, Yuma Cho, Ikuko Koyama-Honda, Akihiko Tanimura, Kenji Matsuzawa i Junichi Ikenouchi, 23 września 2024 r., Aktualna biologia.
DOI: 10.1016/j.cub.2024.08.057