Naukowcy z EMBL Hamburg i CSSB odkryli mechanizmy molekularne stojące za wchłanianiem witaminy B1 przez organizm, co potencjalnie prowadzi do opracowania strategii zapobiegania ukrytym, niebezpiecznym niedoborom witaminy B1 u pacjentów.
Aneuryna1lub tiamina jest niezbędna do przeżycia komórek, jednak organizm ludzki nie jest w stanie jej wytworzyć. Aby utrzymać zdrowy poziom, ważne jest spożywanie pokarmów takich jak łosoś, rośliny strączkowe i brązowy ryż. Zapewnienie odpowiedniego spożycia jest niezbędne, ponieważ B1 Niedobór może prowadzić do poważnych dysfunkcji układu krążenia i układu nerwowego, niepełnosprawności, a nawet śmierci.
Czasem jednak B1 Niedobór może rozwinąć się w mózgu i innych ważnych narządach jako efekt uboczny niektórych leków. Może się to zdarzyć pomimo normalnego działania B1 we krwi, co często sprawia, że takie niedobory pozostają niewykryte, zanim będzie za późno.
Aby zrozumieć, co kryje się za takimi ukrytymi niedoborami, Grupa Löw w EMBL Hamburg i CSSB oraz współpracownicy z Centrum Biologii Strukturalnej VIB-VUB wykorzystali biologię strukturalną i techniki biofizyczne do zbadania, w jaki sposób witamina B1 podróżuje po naszym organizmie, docierając do różnych tkanek i jakie czynniki mogą utrudniać jej postęp.
Aneuryna1bieg przez płotki
W drodze z jelit do komórek organizmu witamina B1 musi przejść przez kilka błon, które pełnią rolę barier – począwszy od ściany jelita, poprzez naczynia krwionośne, narządy, aż po błony poszczególnych komórek. Najbardziej rygorystyczna z nich to bariera krew-mózg, która uszczelnia mózg przed toksynami, które mogą przedostać się z krwiobiegu. Jednakże bariera utrudnia również przenikanie niezbędnych składników odżywczych, w tym witamin.
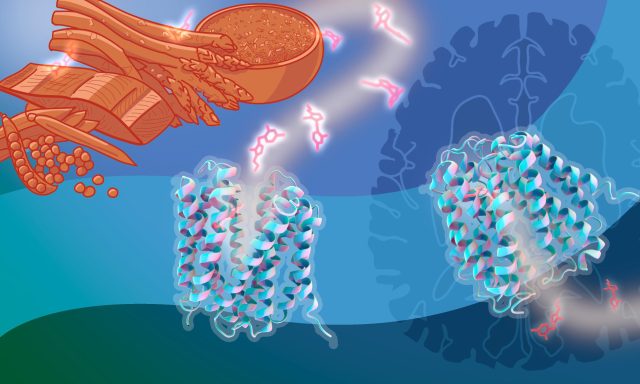
Aby umożliwić witaminom i innym składnikom odżywczym dotarcie do komórek w całym organizmie, błony te są wyposażone w wyspecjalizowane cząsteczki transportowe, które je przepuszczają. W witaminie B1w tym przypadku zadanie to wykonują głównie dwa transportery: SLC19A2 i SLC19A3. Chociaż wiemy, że te transportery są ważne dla zdrowia ludzkiego, nie jest jasne, jak dokładnie działają na poziomie molekularnym.
Aby to odkryć, Grupa Löw zbadała SLC19A3, transporter niezbędny do uzyskania B1 przez ścianę jelita i barierę krew-mózg – dwa kluczowe etapy w podróży witaminy.
Aby obserwować transporter w akcji, stworzyli „film molekularny”, łącząc serię zdjęć uzyskanych za pomocą mikroskopii krioelektronowej (cryo-EM).
„Dzięki temu moglibyśmy uchwycić dynamikę procesu transportu i zwizualizować szczegóły molekularne tego, jak przewoźnik rozpoznaje i popycha B.1 cząsteczki przez błonę komórkową” – powiedział Christian Löw, lider grupy i korespondent autor badania.
Wgląd w rzadkie choroby
Migawki molekularne umożliwiły naukowcom określenie, które części transportera SLC19A3 są najważniejsze dla jego prawidłowego działania. Jeśli te części ulegną awarii, transporter nie będzie działać.
To wyjaśnia, dlaczego mutacje w tych krytycznych częściach upośledzają B1 przedostają się do mózgu i prowadzą do poważnych objawów neurologicznych. Te rzadkie warunkiktóre zaczynają objawiać się w niemowlęctwie, leczy się dużymi dawkami B1 i inne związki. Mimo to jeden na 20 pacjentów umiera, a prawie jedna trzecia nadal ma objawy.
Aby to zbadać, naukowcy stworzyli wersję transportera SLC19A3 niosącą mutację powodującą poważną chorobę mózgu zwaną BTBGD. Pozwala im to dokładnie obserwować, jak mutacja wpływa na strukturę molekularną transportera i czyni go niewrażliwym na B1. Zrozumienie tego mechanizmu chorobotwórczego może pomóc w opracowaniu w przyszłości skuteczniejszych metod leczenia BTBGD.
Leki, które mogą powodować ukrytą B1 braki
Ciężkie B1 Objawy niedoboru mogą być spowodowane nie tylko rzadkimi mutacjami, ale także niektórymi lekami. Kilka powszechnie przepisywanych leków, w tym niektóre leki przeciwdepresyjne, antybiotyki i leki onkologiczne, upośledza SLC19A3. Może to potencjalnie prowadzić do niebezpiecznego B1 niedobory w całym organizmie lub w określonych narządach lub tkankach.
Niedobory specyficzne dla mózgu są szczególnie niebezpieczne, ponieważ mogą wystąpić nawet wtedy, gdy poziom B1 są normalne, co czyni je niewykrywalnymi w standardowych badaniach krwi. Ten ukryty niedobór może po cichu prowadzić do poważnych, potencjalnie śmiertelnych dysfunkcji mózgu.
„Chociaż medycyna zna już kilka leków, które mogą powodować ukryte zakażenie B1 braków, może być ich o wiele więcej, o czym nie jesteśmy świadomi” – powiedział Florian Gabriel, doktorant w EMBL Hamburg i pierwszy autor badania. „Identyfikacja ich nie jest prosta, dlatego nasze badania miały na celu ułatwienie tego. Odkryliśmy molekularne podstawy tego, jak cząsteczki leku blokują transporter SLC19A3 i obecnie wykorzystujemy tę wiedzę do badania wszystkich leków zatwierdzonych przez FDA i EMA pod kątem podobnych efektów.”
Grupa Löw zidentyfikowała również cechy strukturalne, które sprawiają, że lek może upośledzać B1 transport. W tym celu wykorzystali techniki krio-EM i biofizyczne do analizy interakcji znanych blokerów z SLC19A3.
Korzystając z tej wiedzy, zidentyfikowali siedem nowych leków blokujących receptory B1 transporter in vitro i prawdopodobnie robią to również w ludzkim ciele. Należą do nich kilka leków przeciwdepresyjnych i przeciwpasożytniczych hydroksychlorochinai trzy leki przeciwnowotworowe.
Chociaż odkrycia te wymagają jeszcze potwierdzenia na ludziach, stanowią one pierwszy krok w kierunku ochrony pacjentów przed potencjalnie niebezpiecznymi bakteriami B1 braki w przyszłości.
„Wyniki te pomogą nie tylko lepiej monitorować stan zdrowia pacjentów przyjmujących te leki, ale mogą również pomóc w opracowaniu w przyszłości nowych leków, które nie będą miały tych skutków ubocznych” – stwierdził Löw. „Wierzymy, że nasza praca może również stworzyć podstawę do badania interakcji leków z podobnymi transporterami w organizmie człowieka. W dłuższej perspektywie może to również pomóc w projektowaniu przyszłych leków, które będą mogły wykorzystywać te transportery do skuteczniejszego docierania do narządów docelowych”.
Odniesienie: „Strukturalne podstawy transportu tiaminy i rozpoznawania leków przez SLC19A3” autorstwa Floriana Gabriela, Lei Spriestersbach, Antonii Fuhrmann, Kathariny EJ Jungnickel, Siavasha Mostafaviego, Els Pardon, Jana Steyaerta i Christiana Löwa, 2 października 2024 r., Komunikacja przyrodnicza.
DOI: 10.1038/s41467-024-52872-8
Finansowanie: UHH, Deutsche Forschungsgemeinschaft, Boehringer Ingelheim, Nanobodies4Instruct, Instruct-ERIC, EMBO