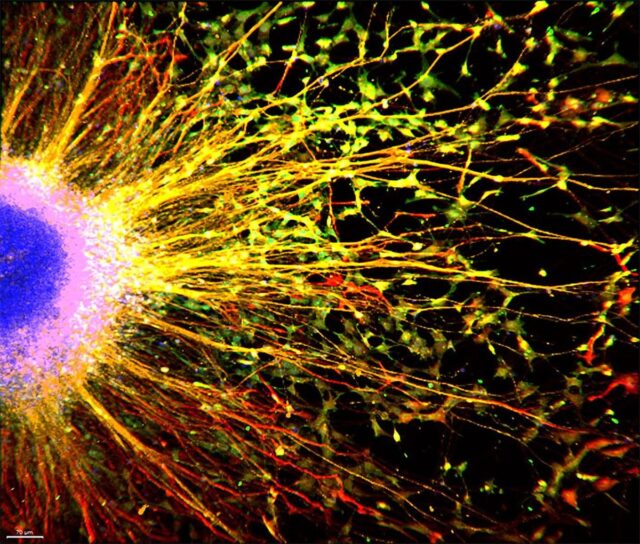
Reprezentatywna kultura organoidu mózgu, w którym gen MECP2 – powodujący zespół Retta – został „wyeliminowany”, jak pokazano pod mikroskopem fluorescencyjnym. Ponieważ kulturę traktowano eksperymentalnym lekiem przeciwnowotworowym ADH-503, utworzyły się nowe synapsy. Źródło: Muotri Lab / Nauki o zdrowiu Uniwersytetu Kalifornijskiego w San Diego
Nowe badanie wskazuje potencjalny cel terapeutyczny w postaci poprawy funkcji poznawczych u pacjentów z różnymi zaburzeniami neurologicznymi.
Nowe badania przeprowadzone na Uniwersytecie Kalifornijskim w San Diego sugerują, że eksperymentalny lek przeciwnowotworowy może poprawić funkcje poznawcze u osób z zespołem Retta, rzadką chorobą związaną z autyzmem. Odkrycie to może potencjalnie pomóc w opracowaniu metod leczenia innych zaburzeń neurologicznych.
Wyniki, opublikowane 25 lipca w Trzon Raporty komórkowepodkreślają rolę mikrogleju – rodzaju białych krwinek występujących w ośrodkowym układzie nerwowym – w tworzeniu ludzkiego mózgu.
Chociaż takie komórki zostały lepiej zbadane w chorobach neurodegeneracyjnych, takich jak Alzheimera stwardnienie zanikowe boczne (ALS) i stwardnienie rozsiane „istnieje bardzo mało informacji na temat ich roli we wczesnych stadiach rozwoju układu nerwowego”, ponieważ dostęp do tkanki płodowej jest ograniczony, stwierdziła dr Pinar Mesci, główny badacz badania . Obecnie zatrudniona gdzie indziej, ukończyła pracę nad projektem jeszcze na uniwersytecie.
Aby lepiej zrozumieć ich funkcję, Mesci zamiast tego użył organoidów mózgowych – „mini-mózgów”, które w zasadzie naśladują rozwijający się mózg embrionu – wyhodowanych z komórek macierzystych pochodzących ze skóry pacjentów, którzy wyrazili na to zgodę. Takie organoidy stworzono od osób z zespołem Retta – zaburzeniem występującym głównie u kobiet, które charakteryzuje się między innymi utratą mowy, celowym używaniem rąk, mobilnością i napięciem mięśni – a także od osób neurotypowych.
Znaczenie mikrogleju w funkcjonowaniu mózgu
Następnie Mesci dodał zdrowy mikroglej do organoidów mózgowych zespołu Retta i odkrył, że funkcjonowanie synaps – gdzie neurony łączą się i komunikują – zostało „uratowane”. Nastąpiło to w wyniku przywrócenia fagocytozy, procesu, w wyniku którego mikroglej — czasami nazywany „woźnymi” centralnego układu nerwowego — wchłania i niszczy obce substancje, takie jak bakterie i martwe komórki, utrzymując mózg i rdzeń kręgowy w porządku. Proces ten polega również na „przycinaniu” synaps, co optymalizuje pracę mózgu.
Naukowcy odkryli również, że synapsy typowych neuronów uległy pogorszeniu po wprowadzeniu mikrogleju z zespołem Retta, co dodatkowo potwierdza rolę komórek odpornościowych w funkcjonowaniu i rozwoju mózgu.
„Jeśli „strażnicy” mózgu nie działają, zaczynają pojawiać się problemy” – stwierdziła profesor Alysson Muotri, doktor medycyny Uniwersytetu Kalifornijskiego w San Diego, starsza autorka i dyrektor zintegrowanego kosmicznego badania orbitalnego komórek macierzystych Instytutu Komórek Macierzystych Uniwersytetu Sanford. Centrum.
Wadliwy mikroglej jeszcze bardziej utrudnia funkcje poznawcze u pacjentów z zespołem Retta, którzy już borykają się z mniejszą liczbą upośledzonych synaps i dysfunkcyjnych astrocytów z powodu utraty funkcji genu MECP2, co ma również związek z innymi typami schorzeń neurorozwojowych.
Mikroglej z utratą funkcji MECP2 „nie jest tak dobry w przycinaniu synaps i kształtowaniu sieci neuronowej — nie radzi sobie zbyt dobrze” – powiedział Muotri.
Następnie zespół przetestował zestaw istniejących leków na mikrogleju, aby sprawdzić, czy którykolwiek z nich mógłby przywrócić fagocytozę. Znaleźli jeden: ADH-503, znany również jako GB1275 – eksperymentalny doustny lek na raka trzustki, który zmniejsza również liczbę komórek immunosupresyjnych przedostających się do guza. Lek służy jako regulator CD11b, białka biorącego udział między innymi w fagocytozie.
Inne badania dotyczące zespołu Retta podkreśliły potencjalne cele terapeutyczne. Jednak jak dotąd nikt nie zidentyfikował potencjalnego leczenia z udziałem ludzkich komórek mikrogleju.
Do czasu zdiagnozowania u pacjentów z zespołem Retta jest już za późno na naprawę, a obecnie nie jest możliwa wymiana uszkodzonych neuronów, będących głównym problemem tej choroby. „Ale skupiając się na innych typach komórek i potencjalnie znajdując leki, które poprawiają ich działanie, możemy poprawić środowisko dla tych neuronów i ułatwić funkcjonowanie pacjentom” – powiedział Mesci. „To właśnie mnie ekscytuje”.
Szersze implikacje dla zaburzeń neurologicznych
Doktor Jonathan Kipnis, profesor patologii, immunologii, neurologii, neuronauki i neurochirurgii w Washington University School of Medicine w St. Louis i dyrektor Brain Immunology and Glia Center, stwierdził, że nowe badanie „ładnie pokazuje” obecność mikrogleju jako potencjalny cel terapeutyczny w zespole Retta.
„Mam nadzieję, że ta praca „poruszy igłę” i sprowadzi społeczność Retta z powrotem do neuroimmunologii” – powiedział Kipnis. „Zrozumienie interakcji neuroimmunologicznych w tej złożonej chorobie może nie tylko dostarczyć nowego wglądu w biologię choroby, ale także opracować nowe podejścia do osłabiania jej postępu”.
Badanie stanowi pierwszą udaną integrację ludzkiego mikrogleju z tkankami mózgowymi zespołu Retta in vitro — model, który może okazać się lepszy od modeli mysich.
Naukowcy mają nadzieję, że badanie „otwiera drzwi do terapii” nie tylko dla osób z zespołem Retta, ale także dla osób z innymi zaburzeniami neurorozwojowymi i neurodegeneracyjnymi, w których rolę odgrywa mikroglej.
„To moje życzenie” – powiedział Mesci – „abyśmy mogli poprawić jakość życia”.
Literatura: „Ludzkie komórki mikrogleju jako cel terapeutyczny w modelu choroby neurorozwojowej” autorstwa Pinara Mesci, Christophera N. LaRock, Jacoba J. Jeziorskiego, Hideyuki Nakashima, Natalia Chermont, Adriano Ferrasa, Roberto H. Herai, Tomoka Ozaki, Aurian Saleh, Cedric E. Snethlage, Sandra Sanchez, Gabriela Goldberg, Cleber A. Trujillo, Kinichi Nakashima, Victor Nizet i Alysson R. Muotri, 25 lipca 2024 r., Raporty dotyczące komórek macierzystych.
DOI: 10.1016/j.stemcr.2024.06.013
Współautorami badania są Christopher LaRock z Wydziału Pediatrii Szkoły Medycznej Uniwersytetu Kalifornijskiego w San Diego oraz Szkoły Farmacji i Nauk Farmaceutycznych w Skaggs; Jacob J. Jeziroski, Natalia Chermount, Tomoka Ozaki, Aurian Saleh, Cedric E. Snethlage, Sandra Sanchez, Gabriela Goldberg, Clever A. Trujillo i Kinichi Nakashima, ze Szkołą Medyczną Uniwersytetu Kalifornijskiego w San Diego i Wydziałem Pediatrii w Rady Children’s Szpital San Diego i Wydział Medycyny Komórkowej i Molekularnej; Hideyuki Nakashima z Wydziału Biologii i Medycyny Komórek Macierzystych Wyższej Szkoły Medycznej Uniwersytetu Kyushu; Adriano Ferrasa z Eksperymentalnym Laboratorium Wielu Użytkowników w ramach Programu dla Absolwentów Nauk o Zdrowiu w Szkole Medycznej na Pontifícia Universidade Católica do Paraná w Kurytybie, Paraná, Brazylia, a także na Wydziale Informatyki na Universidade Estadual de Ponta Grossa w Ponta Grossa , Parana, Brazylia; Roberto H. Herai z Eksperymentalnego Laboratorium dla Wielu Użytkowników w ramach Programu dla Absolwentów Nauk o Zdrowiu w Szkole Medycznej na Pontifícia Universidade Católica do Paraná w Kurytybie, Paraná, Brazylia oraz Dział Badań w Instytucie Lico Kaesemodel w Kurytybie, Paraná, Brazylia; oraz Victor Nizet z Wydziału Pediatrii Szkoły Medycznej Uniwersytetu Kalifornijskiego w San Diego i Szkoły Farmacji i Nauk Farmaceutycznych w Skaggs.
Prace te były częściowo możliwe dzięki grantowi Kalifornijskiego Instytutu Medycyny Regeneracyjnej (CIRM) dla głównych obiektów (FA1-00607) dla Konsorcjum Medycyny Regeneracyjnej w Sanford. Muotri jest wspierany przez Narodowy Instytut Zdrowia (NIH) R01MH107367, R01HD107788, R01NS105969 i R01NS123642 oraz grant Międzynarodowej Fundacji na rzecz Zespołu Retta (IRSF). Praca ta została również częściowo sfinansowana z nagrody IRSF Innovation Award przyznanej Mesci (grant nr 3905). Projekt Herai finansowany jest przez Fundação Araucária (grant nr FA09/2016). Praca ta była również częściowo sfinansowana przez AMED (JP22mg1310008), grant badawczy stacjonarny (3-9) w zakresie zaburzeń neurologicznych i psychiatrycznych przyznawany przez NCNP dla Nakashimy oraz Japońskie Towarzystwo Promocji Nauki (JSPS) KAKENHI (JP22K15201) dla Nakashimy. Niniejsza publikacja zawiera dane wygenerowane w Centrum Genomiki IGM Uniwersytetu Kalifornijskiego w San Diego przy użyciu aparatu Illumina NovaSeq 6000 zakupionego dzięki funduszom z grantu NIH SIG (nr S10 OD026929).
Ujawnienia: Muotri jest współzałożycielem i ma udziały w TISMOO, firmie zajmującej się analizą genetyczną i organogenezą ludzkiego mózgu, skupiającą się na zastosowaniach terapeutycznych dostosowanych do potrzeb zaburzenie ze spektrum autyzmu i inne zaburzenia neurologiczne o podłożu genetycznym. Warunki tego porozumienia zostały sprawdzone i zatwierdzone przez Uniwersytet Kalifornijski w San Diego zgodnie z jego polityką dotyczącą konfliktu interesów. Autorzy posiadają zgłoszenie patentowe w pracach związanych z niniejszą publikacją.