
Nowe badanie przeprowadzone w Japonii pokazuje, że dopamina może pomóc w zmniejszeniu objawów choroby Alzheimera poprzez zwiększenie poziomu neprylizyny – enzymu rozpuszczającego szkodliwe płytki mózgowe. To odkrycie, którego skuteczność udowodniono na myszach, może zmienić podejście do leczenia, jeśli będzie miało zastosowanie u ludzi. Źródło: SciTechDaily.com
Odkryli to japońscy badacze dopamina leczenie mogłoby złagodzić Alzheimera objawy poprzez promowanie produkcji neprylizyny – enzymu rozkładającego szkodliwe płytki mózgowe.
Ten przełom w modelach mysich oferuje potencjał dla nowego podejścia do leczenia, jeśli zostanie powtórzony w badaniach na ludziach, podkreślając znaczenie dopaminy w leczeniu choroby i otwierając nowe możliwości badań.
Dopamina: nowa nadzieja dla choroby Alzheimera
Takaomi Saido i jego zespół w RIKEN Center for Brain Science (CBS) w Japonii odkrył nowy sposób walki z chorobą Alzheimera. Wykorzystując myszy do leczenia tej choroby, naukowcy odkryli, że leczenie dopaminą może złagodzić objawy fizyczne w mózgu, a także poprawić pamięć.
Opublikowano dzisiaj (6 sierpnia) w czasopiśmie naukowym Sygnalizacja naukowaw badaniu zbadano rolę dopaminy w pobudzaniu produkcji neprylizyny – enzymu, który może rozkładać szkodliwe blaszki w mózgu, które są cechą charakterystyczną choroby Alzheimera. Jeśli podobne wyniki zostaną znalezione w badaniach klinicznych na ludziach, może to prowadzić do całkowicie nowego sposobu leczenia tej choroby.
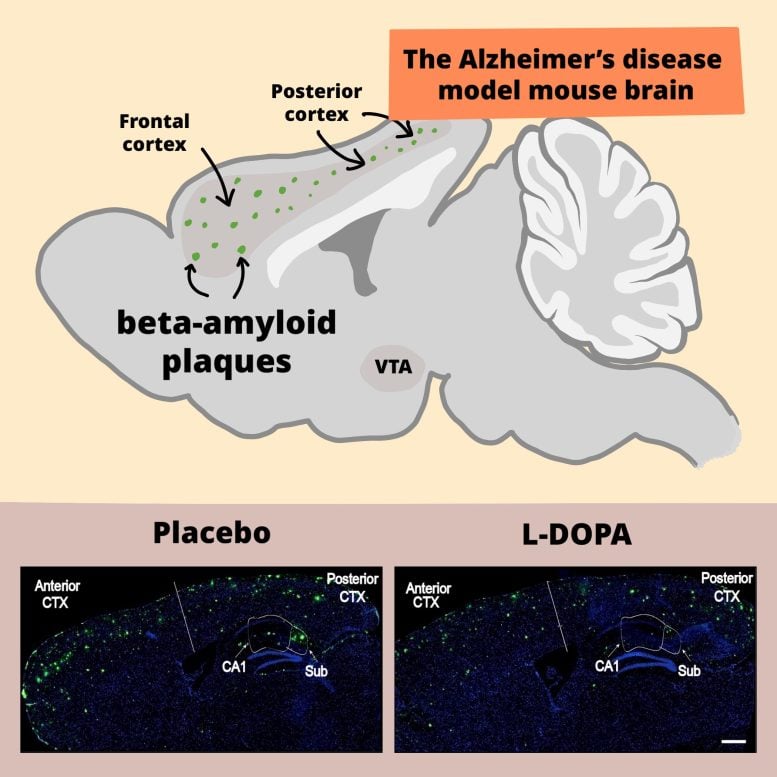
(U góry) Schemat mózgu myszy w modelu choroby Alzheimera. Zielone kropki reprezentują płytki amyloidu-beta. (Na dole) Wyniki eksperymentów po leczeniu modelowych myszy placebo lub L-DOPA przez 3 miesiące. Po leczeniu należy zwrócić uwagę na zmniejszenie poziomu beta-amyloidu (oznaczonego fluorescencyjnie na zielono) zarówno w korze czołowej, jak i tylnej. Źródło: RIKEN
Rola płytek beta-amyloidowych
Tworzenie się stwardniałych płytek wokół neuronów jest jednym z najwcześniejszych objawów choroby Alzheimera i często zaczyna się kilkadziesiąt lat przed wykryciem objawów behawioralnych, takich jak utrata pamięci. Płytki te powstają z kawałków peptydu beta-amyloidu, które gromadzą się z biegiem czasu.
W nowym badaniu zespół Saido z RIKEN CBS skupia się na enzymie neprylizynie, ponieważ poprzednie eksperymenty wykazały, że manipulacja genetyczna powodująca wytwarzanie nadmiaru neprylizyny w mózgu – proces zwany regulacją w górę – skutkuje mniejszą liczbą płytek beta-amyloidowych i poprawą pamięci u myszy.
W poszukiwaniu praktycznego leczenia
Genetyczne manipulowanie myszami w celu wytworzenia neprylizyny jest przydatne eksperymentalnie, ale w leczeniu osób chorych potrzebujemy sposobu, aby to zrobić za pomocą leków. Tabletki neprylizyny lub zastrzyk nie są możliwe, ponieważ nie może ona przedostać się do mózgu z krwiobiegu.
Dlatego pierwszym krokiem w nowym badaniu było żmudne badanie przesiewowe wielu cząsteczek w celu ustalenia, które z nich mogą w naturalny sposób zwiększać poziom neprylizyny w odpowiednich częściach mózgu. Poprzednie badania zespołu doprowadziły do zawężenia poszukiwań do hormonów wytwarzanych przez podwzgórze i odkryli, że podanie dopaminy do komórek mózgowych hodowanych na naczyniu powoduje zwiększenie poziomu neprylizyny i zmniejszenie poziomu swobodnie unoszącego się beta-amyloidu.
Eksperymentowanie z aktywacją dopaminy
Teraz rozpoczęły się poważne eksperymenty. Korzystając z systemu DREADD, wprowadzili maleńkie receptory projektanta do neuronów wytwarzających dopaminę w brzusznym obszarze nakrywkowym myszy. Dodając do pożywienia myszy odpowiednio dobrany lek, badacze byli w stanie w sposób ciągły aktywować te neurony i tylko te neurony w mózgach myszy. Podobnie jak w szalce, aktywacja doprowadziła do zwiększenia poziomu neprylizyny i zmniejszenia poziomu swobodnie unoszącego się beta-amyloidu, ale tylko w przedniej części mózgu myszy.
Ale czy zabieg mógłby usunąć płytki nazębne? Tak. Naukowcy powtórzyli eksperyment, wykorzystując specjalny mysi model choroby Alzheimera, u którego rozwijają się płytki beta-amyloidowe. Osiem tygodni przewlekłego leczenia spowodowało znacznie mniej płytek w korze przedczołowej tych myszy.
L-DOPA: od choroby Parkinsona do choroby Alzheimera
System DREADD to niesamowity system precyzyjnej manipulacji konkretnymi neuronami. Jednak nie jest to zbyt przydatne w warunkach klinicznych u ludzi. W końcowych eksperymentach sprawdzano efekty leczenia L-DOPA. L-DOPA jest cząsteczką prekursora dopaminy, często stosowaną w leczeniu choroby Parkinsona, ponieważ może przedostać się z krwi do mózgu, gdzie następnie przekształca się w dopaminę. Leczenie modelowych myszy L-DOPA doprowadziło do zwiększenia poziomu neprylizyny i zmniejszenia liczby płytek beta-amyloidowych zarówno w przedniej, jak i tylnej części mózgu. Modelowe myszy leczone L-DOPA przez 3 miesiące również radziły sobie lepiej w testach pamięci niż nieleczone myszy modelowe.
Testy wykazały, że u zdrowych myszy poziom neprylizyny naturalnie zmniejsza się wraz z wiekiem, szczególnie w przedniej części mózgu, co być może czyni ją dobrym biomarkerem w diagnostyce przedklinicznej choroby Alzheimera lub choroby Alzheimera zagrożonej. Sposób, w jaki dopamina powoduje wzrost poziomu neprylizyny, pozostaje nieznany i jest to kolejny temat badawczy grupy Saido.
Przyszłe kierunki badań i wyzwania
„Wykazaliśmy, że leczenie L-DOPA może pomóc w redukcji szkodliwych płytek beta-amyloidowych i poprawie funkcji pamięci w mysim modelu choroby Alzheimera” – wyjaśnia Watamura Naoto, pierwszy autor badania. „Ale wiadomo, że leczenie L-DOPA ma poważne skutki uboczne u pacjentów z chorobą Parkinsona. Dlatego naszym kolejnym krokiem jest zbadanie, w jaki sposób dopamina reguluje neprylizynę w mózgu, co powinno zaowocować nowym podejściem zapobiegawczym, które można wdrożyć na przedklinicznym etapie choroby Alzheimera”.
Odniesienie: 6 sierpnia 2024 r., Sygnalizacja naukowa.
DOI: 10.1126/scisignal.adk1822







