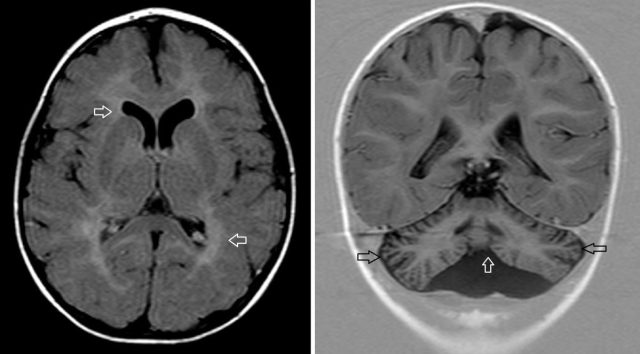
Naukowcy z Uniwersytetu Waszyngtońskiego odkryli nowe zaburzenie genetyczne wpływające na zwijanie białek, oferując potencjalne nowe możliwości leczenia rzadkich chorób mózgu.
Większość osób, które źle się czują, udają się do lekarza, oczekują jasnej diagnozy i planu leczenia. Jednak w przypadku około 30 milionów Amerykanów cierpiących na rzadkie choroby ich objawy nie odpowiadają dobrze znanym wzorcom chorób i mogą spędzić lata, a nawet całe życie, szukając diagnozy.
Przełom w zrozumieniu nowej choroby genetycznej
Teraz zespół naukowców z Washington University School of Medicine w St. Louis oraz międzynarodowi współpracownicy rozwiązali zagadkę dziecka cierpiącego na rzadką chorobę genetyczną, która nie pasowała do żadnej znanej choroby. Zespół odkrył powiązanie między objawami neurologicznymi dziecka a zmianą genetyczną wpływającą na prawidłowe składanie białek w komórkach, umożliwiając rodzicom diagnozę molekularną i identyfikując zupełnie nowy typ zaburzenia genetycznego.
Wyniki tych badań opublikowano niedawno w czasopiśmie Naukamoże prowadzić do nowych metod leczenia rzadkich wad rozwojowych mózgu.

Postęp w badaniach genetycznych
„Wielu pacjentów z ciężką, rzadką chorobą genetyczną pozostaje niezdiagnozowanych pomimo szeroko zakrojonej oceny lekarskiej” – powiedział dr Stephen Pak, profesor pediatrii i współautor badania. „Nasze badanie pomogło rodzinie lepiej zrozumieć chorobę ich dziecka, zapobiegając dalszym niepotrzebnym ocenom klinicznym i testom. Odkrycia umożliwiły także zidentyfikowanie 22 dodatkowych pacjentów z tymi samymi lub nakładającymi się objawami neurologicznymi i zmianami genetycznymi wpływającymi na zwijanie białek, torując drogę dla jeszcze większej liczby diagnoz, a ostatecznie potencjalnych metod leczenia”.
Według Paka około 10% pacjentów z podejrzeniem chorób genetycznych ma wariant genu, którego nie powiązano jeszcze z chorobą. Jego kariera zawodowa skupiała się na rozwiązywaniu takich medycznych zagadek.
Pak i autor dr Tim Schedl, profesor genetyki i współdyrektor centrum badań przesiewowych organizmów modelowych w WashU Medicine, wykorzystują maleńkie glisty zwane C. elegancja w celu oceny, czy za występujące u nich objawy odpowiadają określone zmiany genetyczne stwierdzone u niezdiagnozowanych pacjentów. Dzięki funduszom z Narodowego Instytutu Zdrowia Dziecka i Rozwoju Człowieka Eunice Kennedy Shriver Narodowe Instytuty Zdrowia (NIH) oni i zespół badaczy z WashU Medicine zobowiązali się do rozwiązania większej liczby takich przypadków.
Metodologia i ustalenia
Na potrzeby tego badania połączyli siły z badaczami i lekarzami z kilkunastu instytucji w Ameryce Północnej, Europie, Indiach i Chinach, aby zidentyfikować przyczynę zespołu objawów klinicznych u chłopca z Niemiec i innych podobnych przypadków. Niemiecki pacjent miał niepełnosprawność intelektualną, niskie napięcie mięśniowe i mały mózg o nieprawidłowej budowie. Lekarze stwierdzili także zmiany w CCT3 gen, dlatego zespół Paka postanowił ustalić, czy może to być przyczyną stanu pacjenta.
C. elegancja ma odpowiedniki około 50% ludzkich genów, w tym CCT3 gen, tzw cct-3 u glisty. Odkrył to dr Weimin Yuan, pracownik naukowy w dziedzinie pediatrii i współpierwszy autor C. elegancja z wariantem genetycznym pacjenta poruszały się wolniej niż glisty ze zdrową kopią genu, co pokazuje, że zmiana genetyczna może wpływać na mobilność i układ nerwowy.
Dotknięte białko CCT3 jest częścią dużego kompleksu molekularnego TRIC/CCT, którego zadaniem jest zwijanie innych białek w ich właściwy kształt, tak aby działały w komórkach tak, jak powinny. Badanie wykazało, że mechanizm zwijający białka nie może działać bez określonej ilości zdrowego CCT3.
„Wiedzieliśmy, że dziecko ma jedną dobrą i jedną złą kopię genu” – powiedział Schedl. „Nasze studia w C. elegancja ujawniło, że zmiana genetyczna zmniejsza aktywność normalnego białka, zmniejszając wydajność maszynerii zwijającej białko, i że w obu przypadkach C. elegans cct-3 i ludzkie CCT3, posiadanie 50% aktywności było niewystarczające do normalnego funkcjonowania biologicznego.”
Odkryli, że w wyniku ograniczenia mechanizmów zwijających białka białka aktyny – pomagające w utrzymaniu kształtu i ruchu komórek – były nieprawidłowo sfałdowane i nieprawidłowo rozmieszczone w komórkach C. elegancja który niósł wariant pacjenta.
„Zrozumienie wpływu zmiany genetycznej wpływa na sposób leczenia” – dodał Schedl, „ponieważ leczenie potrzebne do zwiększenia ilości normalnego białka różni się od leczenia potrzebnego, gdy białko jest trujące lub nadaktywne”.
Współpracownicy z Uniwersytetu RWTH Aachen w Niemczech i Uniwersytetu Stanforda przeprowadzili uzupełniające badania cct3 warianty u danio pręgowanego – które naświetliły wpływ genu na rozwój mózgu – i u drożdży, co wyjaśniło odpowiednio jego rolę w zwijaniu białek.
Implikacje dla przyszłych terapii i diagnoz
Aby ustalić, czy inni pacjenci cierpią na to samo zaburzenie, badacze przeszukali ogólnodostępną globalną bazę danych dotyczącą osób z niepełnosprawnością intelektualną i rozwojową. Zidentyfikowali 22 osoby ze zmianami genetycznymi w siedmiu z ośmiu białek CCT tworzących maszynę zwijającą białka. Nieprawidłowości w ruchliwości i fałdowaniu aktyny ponownie zaobserwowano u nicieni z wariantami wpływającymi na białka CCT1 i CCT7, podobnie jak zespół WashU Medicine zaobserwował w przypadku dysfunkcjonalnego CCT3. Razem pacjenci ci reprezentują nowy typ rzadkiej choroby genetycznej związanej z maszynerią zwijania białek.
„Ta praca podkreśla znaczenie wykorzystania prostszych organizmów modelowych, takich jak C. elegancjaaby zapewnić nowatorski wgląd w patobiologię człowieka” – powiedział współautor Gary Silverman, lekarz medycyny, Harriet B. Spoehrer, profesor pediatrii i kierownik Katedry Pediatrii.
„Nasze odkrycia mogą poinformować klinicystów, społeczność naukową oraz pacjentów i rodziny na całym świecie, że zmiany w przekazie genetycznym niezbędne do tego, aby kompleks ośmiu białek powodował chorobę” – dodał Pak, który wraz ze Schedlem i zespołem badaczy Celem finansowanych przez NIH badaczy z WashU Medicine jest rozwiązywanie trudnych zagadek medycznych przy użyciu zaawansowanych technologii. „Jeśli w przyszłym tygodniu u pacjenta z wadami rozwojowymi mózgu i objawami neurologicznymi zostanie wykryta odmiana wpływająca na maszynę zwijającą białka, pacjent otrzyma diagnozę”.
Odniesienie: „Wady rozwojowe mózgu i drgawki spowodowane upośledzoną funkcją TRiC” autorstwa Floriana Krafta, Piere’a Rodrigueza-Aliagi, Weimina Yuana, Leny Franken, Kamila Zajta, Dimaha Hasana, Ting-Tinga Lee, Elisabetty Flex, Andreasa Hentschela, A. Micheila Innesa , Bixia Zheng, Dong Sun Julia Suh, Cordula Knopp, Eva Lausberg, Jeremias Krause, Xiaomeng Zhang, Pamela Trapane, Riley Carroll, Martin McClatchey, Andrew E. Fry, Lisa Wang, Sebastian Giesselmann, Hieu Hoang, Dustin Baldridge, Gary A. Silverman, Francesca Clementina Radio, Enrico Bertini, Andrea Ciolfi, Katherine A Blood , Jean-Madeleine de Sainte Agathe, Perrine Charles, Gaber Bergant, Goran Čuturilo, Borut Peterlin, Karin Diderich, Haley Streff, Laurie Robak, Renske Oegema, Ellen van Binsbergen, John Herriges, Carol J. Saunders, Andrea Maier, Stefan Wolking, Yvonne Weber, Hanns Lochmüller, Stefanie Meyer, Alberto Aleman, Kiran Polavarapu, Gael Nicolas, Alice Goldenberg, Lucie Guyant, Kathleen Papież, Katherine N. Hehmeyer, Kristin G. Monaghan, Annegret Quade, Thomas Smol, Roseline Caumes, Sarah Duerinckx, Chantal Depondt, Wim Van Paesschen, Claudine Rieubland, Claudia Poloni, Michel Guipponi, Severine Arcioni, Marije Meuwissen, Anna C. Jansen , Jessica Rosenblum, Tobias B. Haack, Miriam Bertrand, Lea Gerstner, Janine Magg, Olaf Riess, Jörg B. Schulz, Norbert Wagner, Martin Wiesmann, Joachim Weis, Thomas Eggermann, Matthias Begemann, Andreas Roos, Martin Häusler, Tim Schedl, Marco Tartaglia, Juliane Bremer, Stephen C. Pak, Judith Frydman, Miriam Elbracht i Ingo Kurth, 31 październik 2024, Nauka.
DOI: 10.1126/science.adp8721
Praca ta była wspierana przez Narodowy Instytut Zdrowia Dziecka i Rozwoju Człowieka Narodowego Instytutu Zdrowia (NIH), numer grantu R01 HD110556; NIH, numery grantów GM74074 i GM56433; Instytut Odkryć Dzieci, Fundacja Szpitala Dziecięcego w St. Louis; Włoskie Ministerstwo Zdrowia, numery grantów RCR-2022-23682289 i PNRR-MR1-2022-12376811; Kanadyjski Instytut Badań nad Zdrowiem (CIHR) w ramach grantu fundacyjnego, numer grantu FDN-167281; Grant Zespołu Transnarodowego, numer grantu ERT-174211; grant sieciowy OR2-189333, numer grantu NMD4C; Kanadyjska Fundacja na rzecz Innowacji, numer grantu CFI-JELF 38412; program Canada Research Chairs (Kanada Research Chair in Neuromuscular Genomics and Health), numer grantu 950-232279; Komisja Europejska, numer grantu 101080249; Kanadyjski Komitet Koordynacyjny ds. Badań New Frontiers in Research Fund, grant nr NFRFG-2022-00033 oraz od rządu Kanady, Canada First Research Excellence Fund (CFREF) na rzecz połączenia międzysystemowego Brain-Heart Interconnectome, grant nr CFREF-2022-00007; staż podoktorski CIHR; Niemiecka Fundacja Badawcza, numer grantu WO 2385/2-1; Deutsche Forschungsgemeinschaft (DFG, Niemiecka Fundacja Badawcza), numery grantów WE 1406/16-1, WE 1406/17-1, 418081722, 433158657, 499059538, INST 222/1458-1 FUGG, KU 1587/6-1, KU 1587/9-1, KU 1587/10-1 i KU 1587/11-1; „Ministerium für Kultur und Wissenschaft des Landes Nordrhein-Westfalen”, numer grantu PROFILNRW-2020–107-A; „Der Regierende Bürgermeister von Berlin, Senatskanzlei Wissenschaft und Forschung”; staż podoktorski w Fundacji Chorób Dziedzicznych (2019-2023); dłuższe konsorcjum; programu badań i innowacji Unii Europejskiej Horyzont 2020 w ramach EJP RD COFUND-EJP, numer grantu 825575. Za treść odpowiadają wyłącznie autorzy i niekoniecznie odzwierciedlają poglądy PZH.